Познавательная передача «Большой скачок» — Когда смотреть? В 01:40 ( 29 сентября 2018 ) , Владивосток
Иммунитет против хозяина
День за днем, 24 часа в сутки нас атакуют возбудители болезней: микробы и вирусы. Но мы этого не замечаем, ведь на страже нашего здоровья стоит иммунитет. Мощная система, которая работает без устали. В норме иммунитет уничтожает «все чужое», а свои собственные ткани и органы остаются невредимыми. Но почему при некоторых обстоятельствах он начинает атаковать собственный организм?
Ревматоидный артрит, некоторые виды аллергий, рассеянный склероз, красная волчанка и многие другие заболевания называют аутоиммунными. Как ни парадоксально, эти диагнозы связаны с сильным иммунитетом. Настолько сильным, что он запускает в организме программу саморазрушения. Но почему? Сегодня ученые только приближаются к разгадке механизмов возникновения аутоиммунных заболеваний.
Ясно одно: по статистике 80 процентов всех аутоиммунных заболеваний приходится на развитые страны.
+12
Наука 2.0
Ошибка в расписанииВоскресенье 01:40
Большой скачок
Иммунитет против хозяина
Канал «Наука 2.0»
В это время была передача:
Ваше сообщение будет рассмотрено в ближайшее время. Спасибо!
Спасибо!
День за днем, 24 часа в сутки нас атакуют возбудители болезней: микробы и вирусы. Но мы этого не замечаем, ведь на страже нашего здоровья стоит иммунитет. Мощная система, которая работает без устали. В норме иммунитет уничтожает «все чужое», а свои собственные ткани и органы остаются невредимыми. Но почему при некоторых обстоятельствах он начинает атаковать собственный организм?
Ревматоидный артрит, некоторые виды аллергий, рассеянный склероз, красная волчанка и многие другие заболевания называют аутоиммунными.
Как ни парадоксально, эти диагнозы связаны с сильным иммунитетом. Настолько сильным, что он запускает в организме программу саморазрушения. Но почему? Сегодня ученые только приближаются к разгадке механизмов возникновения аутоиммунных заболеваний.
Ясно одно: по статистике 80 процентов всех аутоиммунных заболеваний приходится на развитые страны. А вот в трущобах Индии или в африканских племенах, где жизнь не назовешь «цивилизованной», такие случаи — редкость. Можно списать это на слабую медицинскую диагностику.
Можно списать это на слабую медицинскую диагностику.
Но дело, как оказалось, не только в этом.
Так по какой причине возникают аутоиммунные заболевания? Какую роль в этом играет чрезмерная гигиена? И можно ли приструнить «взбесившийся иммунитет»? Об этом в новом выпуске «Иммунитет против хозяина» из цикла «Большой скачок».
Продолжительность
30 минут
Познавательная передача «Большой скачок» — Когда смотреть? В 19:40 ( 08 июля 2020 ) , Хабаровск
Иммунитет против хозяина
Научно-популярная познавательная линейка фильмов о достижениях российской и мировой науки. Цель — рассказать в интересной и доступной форме о вещах и явлениях, которые окружают человека в повседневной жизни, и о том, как они влияют на жизнь самого человека.
Герои фильмов — учёные, инженеры, изобретатели — люди, которые меняют наш мир день за днём.
Наука 2.0
Ошибка в расписанииСреда 19:40
Большой скачок
Иммунитет против хозяина
Канал «Наука 2.0»
В это время была передача:
Ваше сообщение будет рассмотрено в ближайшее время. Спасибо!
Спасибо!
Научно-популярная познавательная линейка фильмов о достижениях российской и мировой науки. Цель — рассказать в интересной и доступной форме о вещах и явлениях, которые окружают человека в повседневной жизни, и о том, как они влияют на жизнь самого человека.
Герои фильмов — учёные, инженеры, изобретатели — люди, которые меняют наш мир день за днём. Фильмы цикла рассказывают и показывают, как работают технологии, как создаются вещи, которые нас окружают.
Главная цель проекта — популяризация российской науки.
Большинство зрителей даже не представляют, что происходит в современной российской науке. Сегодня наши ученые разрабатывают уникальные технологии, зачастую не имеющие аналогов в мире. Рассказывая о современной российской науке, мы не забываем и о её великом прошлом — о советских ученых, их достижениях и вкладе в мировую науку.
Продолжительность
30 минут
Программа передач Доктор на 3 января 2021 г.
 , воскресенье. Беседка.ТВ
, воскресенье. Беседка.ТВ05:05 Эпидемия, «Испанский грипп»
06:00 Большой скачок, «Антиоксиданты: правда и мифы»
06:30 Большой скачок, «Обратная сторона ЗОЖ»
07:00 Химия нашего тела, «Витамины»
07:50 Большой скачок, «Детокс: научный подход»
08:20 Большой скачок, «Иммунитет против хозяина»08:50 Химия нашего тела, «Сахар»
09:40
Большой скачок, «Гормоны. На страже здоровья»
На страже здоровья»
10:10 Большой скачок, «Гормоны. На страже красоты»
11:30 Мир невыспавшихся людей
12:30 Биологические часы — как они работают?
13:25 Большой скачок, «Антиоксиданты: правда и мифы»
13:55 Большой скачок, «Обратная сторона ЗОЖ»
14:25 Химия нашего тела, «Витамины»15:20 Большой скачок, «Детокс: научный подход»
15:50 Большой скачок, «Иммунитет против хозяина»
16:20 Химия нашего тела, «Сахар»
17:10
Большой скачок, «Гормоны.
17:40 Большой скачок, «Гормоны. На страже красоты»
18:10 Витамины. Польза или плацебо
19:00 Мир невыспавшихся людей
20:00 Биологические часы — как они работают?
20:55 Большой скачок, «Антиоксиданты: правда и мифы»
21:25 Большой скачок, «Обратная сторона ЗОЖ»
21:55 Химия нашего тела, «Витамины»
22:50 Большой скачок, «Детокс: научный подход»
23:15 Большой скачок, «Иммунитет против хозяина»
23:45 Химия нашего тела, «Сахар»
00:40
Большой скачок, «Гормоны. На страже здоровья»
На страже здоровья»
01:10 Большой скачок, «Гормоны. На страже красоты»
01:35 Витамины. Польза или плацебо
02:25 Мир невыспавшихся людей
03:15 Биологические часы — как они работают?
04:10 Большой скачок, «Детокс: научный подход»
04:35 Большой скачок, «Иммунитет против хозяина»
Наука 2.
 0: программа передач — СатКом
0: программа передач — СатКомНаука 2.0
Основа эфира канала Наука – программы о космосе, медицине, технологиях, истории великих открытий. Редакция канала успешно сотрудничает с ведущими научными центрами. Также канал предлагает программы компаний BBC, OffTheFense, Parthenon.
Сайт телеканала
Программа передач
05:45 Основной элемент». «Ген власти
06:15 Основной элемент». «Человек азартный
06:45 НЕпростые вещи». «Автомат Калашникова
07:15 НЕпростые вещи». «Клюшка и шайба
07:40 Сверхспособности». «Равновесие
08:25 «EXперименты». «Звуки музыки», 3 ч.
08:55 «EXперименты». «Звуки музыки», 4 ч.
09:20 Просто физика». «Да будет свет!
09:50 Самые важные открытия человечества» с Александром Капланом. «Огонь
10:15 НЕпростые вещи». «Скрепка
10:40 НЕпростые вещи». «Газета
11:10 НЕпростые вещи». «Пластиковый стаканчик
11:35 НЕпростые вещи». «Монета
12:00 Изобретатели будущего». «Текстиль. Одежда из натуральных тканей
«Текстиль. Одежда из натуральных тканей
12:55 Вопрос науки». «Люди и сети
13:25 EXперименты». «Мир в миниатюре. Поезда
13:55 «EXперименты». «Необычные здания мира», 4 ч.
14:20 EXперименты». «История знаменитых фотографий
14:50 EXперименты». «Фотографии, которые потрясли мир
15:20 Большой скачок». «Жизнь в ярком свете
15:50 Большой скачок». «Архитектура
16:20 Глубинные механизмы истории». «Возникновение цивилизаций
17:15 Просто физика». «Да будет свет!
17:45 Самые важные открытия человечества» с Александром Капланом. «Огонь
18:15 НЕпростые вещи». «Скрепка
18:45 НЕпростые вещи». «Газета
19:15 НЕпростые вещи». «Пластиковый стаканчик
19:45 НЕпростые вещи». «Монета
20:10 Изобретатели будущего». «Текстиль. Одежда из натуральных тканей
21:10 EXперименты». «Мир в миниатюре. Поезда
21:40 «EXперименты». «Необычные здания мира», 4 ч.
22:05 EXперименты». «История знаменитых фотографий
22:35 EXперименты». «Фотографии, которые потрясли мир
«Фотографии, которые потрясли мир
23:05 Большой скачок». «Жизнь в ярком свете
23:35 Большой скачок». «Архитектура
00:05 Сверхспособности». «Равновесие
01:00 Просто физика». «Да будет свет!
01:30 Самые важные открытия человечества» с Александром Капланом. «Огонь
02:00 НЕпростые вещи». «Скрепка
02:30 НЕпростые вещи». «Газета
03:00 НЕпростые вещи». «Пластиковый стаканчик
03:30 НЕпростые вещи». «Монета
04:00 Изобретатели будущего». «Текстиль. Одежда из натуральных тканей
04:55 Агрессивная среда». «Экстремальное выживание
Новинки в приложении: «Большой скачок»
12 марта в приложении «Моя Планета» появятся две серии из цикла «Большой скачок». Первая будет доступна бесплатно.
Телепроект о достижениях российской и мировой науки. В интересной и доступной форме он рассказывает о вещах и явлениях вокруг нас и о том, как они влияют на жизнь человека. Герои фильмов: ученые, инженеры, изобретатели — объяснят и покажут нам, как работают технологии, как создаются вещи, которые нас окружают.
Герои фильмов: ученые, инженеры, изобретатели — объяснят и покажут нам, как работают технологии, как создаются вещи, которые нас окружают.
Иммунитет против хозяина
День за днем, 24 часа в сутки, нас атакуют возбудители болезней: микробы и вирусы. Но мы этого не замечаем, ведь на страже нашего здоровья стоит иммунитет — мощная система, которая работает без устали. В норме иммунитет уничтожает «все чужое», а свои собственные ткани и органы остаются невредимыми. Но почему в некоторых обстоятельствах он начинает атаковать собственный организм?
Ревматоидный артрит, некоторые виды аллергий, рассеянный склероз, красная волчанка и многие другие заболевания называют аутоиммунными. Как ни парадоксально, эти диагнозы связаны с сильным иммунитетом. Настолько сильным, что он запускает в организме программу саморазрушения. Но почему? Сегодня ученые только приближаются к разгадке механизмов возникновения аутоиммунных заболеваний.
Биохакинг
Идея бессмертия привлекала человека издревле. Однако достичь этого не удалось еще никому. Зная это, мы стараемся избегать мыслей и тем более разговоров о смерти. Слишком безжалостным кажется такой финал, запрограммированный самой природой. Но если он неизбежен, то наверняка есть способы продлить жизнь?
Однако достичь этого не удалось еще никому. Зная это, мы стараемся избегать мыслей и тем более разговоров о смерти. Слишком безжалостным кажется такой финал, запрограммированный самой природой. Но если он неизбежен, то наверняка есть способы продлить жизнь?
Мода на биохакинг завоевывает все новых и новых сторонников. В переводе с английского это слово означает «взломать биологию». Адепты биохакинга верят, что могут увеличить продолжительность жизни, при этом сохранив здоровье и активность. Правда, ученые эту систему называют неоднозначной. Почему? Все ли средства хороши ради эфемерного продления жизни? И что из арсенала биохакеров стоит взять на вооружение обычным смертным?
Скачивайте приложение «Моя Планета» для iOS и Android! У приложения есть трехдневный тестовый период.
Детокс. Научный подход | Большой скачок видео Online
Видео:
youtube.com/embed/W5nqNEMALzM?autoplay=0&iv_load_policy=3&modestbranding=1&rel=0&showsearch=0″ frameborder=»0″ allowfullscreen=»»/>
Почему некоторые из нас, даже сидя на диете годами, не могут похудеть? Отчего, несмотря на прием витамино
Нейролингвистическое программирование — самая демонизированная область человеческого знания. Она вкл
В августе 2018 года Американское управление по санитарному надзору за качеством пищевых продуктов и . ..
..
По поводу вреда курения мало кто спорит. Сигаретный дым содержит сотни токсических веществ. Алкоголь же
Две крайности. Голод и изобилие. История цивилизаций знала и то, и другое. И человеком до сих пор, как и в
Организм живёт гораздо дольше, чем клетки, из которых он состоит. На обновление скелета уходит около 10 л
«Витамин С – лекарство от рака и ключ к вечной молодости!» — с таким сенсационным заголовком в марте 1966 го
Первый эпизод посвящен детоксу – очень модной тенденции сегодняшних дней. Так ли важно регулярно избав
Так ли важно регулярно избав
Подписывайтесь на оба канала, чтобы всегда быть в курсе новых выпусков. Полный перечень магазинов и …
За последние десятилетия в медицине произошёл настоящий переворот! И всё это благодаря витамину D. Борь
Всё больше людей стремятся жить в больших городах — работать на высокооплачиваемой работе, жить в больш
В 4 выпуске 2 сезона «Тайный агент» от 12. 03.2018 журналист проекта Катя Пастушок устроится на предприятие, г
03.2018 журналист проекта Катя Пастушок устроится на предприятие, г
По оценкам психиатров, более 80% жителей больших городов находятся во власти хронической разрушительной
На какие периоды жизни человечества приходится максимальное количество неврозов? Расстройств, вызванн
Почему человек не может жить в абсолютной тишине? Игра на бокалах: как это делается? Как ультразвук испо
В какой РЫБЕ много РТУТИ? В комментариях под роликом про тунца многие опасались, что в нём много ртути. К
К
Канал Доктор — Каталог спутниковых частот
Правила пользователя
На сайте строго запрещено:
1.1 — сообщения, не относящиеся к содержанию статьи или к контексту обсуждения
1.1.1 — постить сообщения не содержащие смысла (lol , 🙂 и т.д.)
1.2 — оскорбление и угрозы в адрес посетителей сайта
1.3 — в комментариях, личных сообщениях и постах форума — запрещаются выражения, содержащие ненормативную лексику, унижающие человеческое достоинство, разжигающие межнациональную рознь. Запрещены любые упоминания о политике, фотографии, карикатуры, анекдоты и прочее.
1.4 — СПАМ, а также реклама любых товаров и услуг, иных ресурсов, СМИ или
событий, не относящихся к контексту обсуждения статьи
1.5 — запрещено публиковать ссылки на любые ресурсы сети во всех постах и
комментариях ,за исключением отведенных тем! Если существует необходимость
опубликовать ссылку по теме, обязательное размещение ссылки под тег HIDE
1. 6 — запрещено заливать файлы больше чем 512 кб в промежуточные(не
первые) посты темы
6 — запрещено заливать файлы больше чем 512 кб в промежуточные(не
первые) посты темы
1.7 — запрещено писать в темах без обсуждения (разрешено только постить по теме)
, обсуждение в других темах
1.8 — запрещено дублировать посты и темы
1.9 — запрещены сообщения в личку или в icq , за исключением вопросов по
работе форума и сайта
1.10 — красный цвет может использовать только
администрация форума, исключением является выделение очень важных
моментов, которые обязательно выполнить, например при прошивке ресивера.
1.11 — На форуме и сайте разрешено использование изображений только загруженных
непосредственно на форум , другие изображения будут удаляться
1.11.1 На форуме запрещено загружать изображения которые не относятся к
спутниковой тематике, разрешено вставлять изображения из других источников,
возможно размещение только под HIDE
По настоятельной рекомендации с насущными вопросами заходить сразу в раздел Вопросы новичков о Сат ТВ
Как вирус, такой как коронавирус, передается от животных к людям
- По оценкам Центров по контролю и профилактике заболеваний, три из каждых четырех новых инфекционных заболеваний человека произошли от другого вида.

- Вирусы все время пытаются заразить новые хосты, но им нужно преодолеть множество препятствий, прежде чем это произойдет.
- Сначала новый вирус должен войти в контакт с людьми, затем преодолеть естественную защиту организма и, наконец, распространиться между людьми.
- Но в любой момент его можно остановить как вкопанный.
- Посетите домашнюю страницу Business Insider, чтобы узнать больше.
Ниже приводится стенограмма видео.
Рассказчик: По оценкам … на Земле существует столько отдельных вирусов. К счастью, известно лишь немногим более 1000 штаммов вирусов, заражающих людей, большинство из которых происходят от других животных.Они входят в группу зоонозных заболеваний, вызываемых бактериями, вирусами, паразитами или грибами. И сейчас мы все сосредоточены на вирусе, вызывающем COVID-19. А новые могут появиться в любой момент. Вот что должно произойти, чтобы вирус перешел от животных к людям.
Вот что должно произойти, чтобы вирус перешел от животных к людям.
В качестве патогена цель вируса — заразить своего хозяина и размножаться, потому что он не может этого сделать сам. Допустим, эта свинья является первоначальным хозяином вируса. Он и его приятели образуют резервуар, особую популяцию животных того же вида, которые естественным образом являются носителями возбудителя.
Колин Пэрриш: Итак, существуют миллионы вирусов, заражающих животных. Буквально миллионы. Я имею в виду, чем больше мы смотрим, тем больше находим. И большинство этих вирусов не заражают других животных. У них ограниченный диапазон хостов.
Экранный диктор: В большинстве случаев вирус не влияет на исходный хост или влияет только на него. Итак, что он там делает? Предположим, что эта свинья является хозяином вируса, который в первую очередь поражает кишечник. Вирусы имеют тенденцию атаковать разные части тела, в зависимости от того, могут ли они связываться с этими парнями. Рецепторы — это белки, которые находятся за пределами клетки и используются для связи с остальным телом. Но вирусы тоже могут зацепиться.
Рецепторы — это белки, которые находятся за пределами клетки и используются для связи с остальным телом. Но вирусы тоже могут зацепиться.
Клетки дыхательной системы могут иметь рецепторы, отличные от клеток пищеварительного тракта. Вирус делает свое дело, цепляясь за клетку-хозяина, проникая в нее или вводя в нее свои части, а затем захватывая ее. Он заставляет клетку создавать копии вируса, которые затем захватывают другие клетки-хозяева. Обычно это убивает клетку-хозяина.И если достаточное количество клеток-хозяев инфицировано и вырабатывает больше вируса, хозяин заразится инфекцией, которая, если организм не сможет с ней бороться или будет бороться слишком усердно, может привести к тяжелой болезни или смерти.
Однако в водоемах этот вид, вероятно, выработал устойчивость к вирусу на протяжении многих поколений. Это позволяет достичь своего рода равновесия; иммунная система контролирует инфекцию, не убивая вирус полностью. Однако, если вирус подскочит, у нового хозяина не будет такого же иммунитета. Это может показаться пугающим, потому что, честно говоря, вы постоянно подвергаетесь воздействию вирусов. Но лишь очень немногим удается заразить новый вид-хозяин.
Это может показаться пугающим, потому что, честно говоря, вы постоянно подвергаетесь воздействию вирусов. Но лишь очень немногим удается заразить новый вид-хозяин.
Это называется вторичным распространением, и существует ряд препятствий, которые вирус должен преодолеть, чтобы это произошло. Если его задержит хотя бы один из них, его можно остановить на месте. В упрощенном виде они представляют две вещи: может ли вирус попасть в клетки нового хозяина и может ли он связываться и проникать в них? Чем больше зараженных свиней находится в одном помещении и чем они ближе к людям, тем выше вероятность распространения инфекции.Но вероятность также связана с тем, как люди взаимодействуют с ними.
Вирусы животных обычно передаются людям несколькими путями: контактом с экскрементами, убой, укусами, контактом с тканями или через промежуточные виды, такие как комары или клещи. Поэтому в таких местах, как фермы, бойни и даже контактные зоопарки, где люди вступают в тесный контакт с животными, существует повышенный риск распространения.
Но одного приближения недостаточно. Некоторые из них могут быть генетическими для человека.Существует огромный список генов, которые связаны с различными рисками инфекций, некоторые гены обеспечивают устойчивость к определенным инфекциям, а другие повышают риск. Помимо генов, вирус должен пройти через врожденные иммунные реакции организма.
Пэрриш : Итак, есть два типа иммунных ответов. Один из них — это простые адаптивные иммунные ответы, то есть это антитела и Т-клетки, и они обычно стимулируются после того, как инфекция уже произошла. Врожденные ответы — это те, которые уже присутствуют внутри клетки, которые делают клетку или хозяина, вы знаете, устойчивыми к вирусу.
Рассказчик: В отличие от адаптивного ответа, врожденный может пытаться бороться с любым патогеном, а не с конкретным. Слизистые оболочки, желудочная кислота, кожа, сигнальные клетки и даже просто отсутствие нужных рецепторов могут остановить вирус от заражения человека. Итак, это когда мутации действительно важны. С оригинальным вирусом обычно не бывает успешного распространения.
Итак, это когда мутации действительно важны. С оригинальным вирусом обычно не бывает успешного распространения.
Пэрриш : Они должны получить некоторые мутации, которые позволят им размножаться наиболее эффективно, позволят им преодолеть эти барьеры хозяина.
Рассказчик: Вирус, поражающий пищеварительную систему свиней, может атаковать респираторные клетки человека. Это зависит от того, для какого рецептора подходит вирус или для которого он мутирует. Попав внутрь новой клетки-хозяина, инфекция будет успешной только в том случае, если вирус сможет реплицироваться. Обычно инфицированные клетки выделяют интерфероны, белки, которые не позволяют вирусу размножаться внутри клетки и в соседних клетках, содержащих инфекцию, и не позволяют ей распространяться на новые клетки.Если это не сработает, сработает адаптивная иммунная система.
Ваши Т-клетки выявляют и убивают уже инфицированные клетки, чтобы помешать им производить новый вирус, в то время как ваши лейкоциты выкачивают антитела, специально предназначенные для борьбы с этим новым патогеном . Но поскольку организм никогда раньше не видел этого вируса, могут потребоваться недели, чтобы произвести нужные вирусы. И иммунодефицит любого типа ответа может еще больше облегчить распространение вируса.
Но поскольку организм никогда раньше не видел этого вируса, могут потребоваться недели, чтобы произвести нужные вирусы. И иммунодефицит любого типа ответа может еще больше облегчить распространение вируса.
Итак, если вирус проходит через все это, контакт, заражение, репликацию, значит, он успешно распространился.Но …
Пэрриш: Вирус должен иметь возможность передавать. Он должен быть доставлен от этого первоначального человека, и он должен быть в состоянии заразить, вы знаете, по крайней мере, еще одного или двух дополнительных людей, чтобы вы могли запустить цепочку передачи.
Рассказчик: Вирус, заражающий двух человек, имеет в два раза больше шансов заразить дополнительных людей по сравнению с вирусом, заражающим только одного. И это может продолжаться до тех пор, пока не достигнет масштабов эпидемии и пандемии.COVID-19 определенно не был первым зоонозом и не последним. Вирусы не хотят убивать своих хозяев; отсутствие хоста означает отсутствие вируса.
Но новые болезни настолько опасны, потому что у людей нет такого же иммунитета, как у резервуарного хозяина вируса. И поскольку их так много, в настоящее время невозможно предсказать, когда или какие конкретные вирусы распространятся, но мы знаем условия, при которых может произойти распространение вирусов. Пэрриш: Вы знаете, как и где они могут произойти, и как мы можем ввести в действие своего рода более эффективный мониторинг, чтобы мы могли поймать их на раннем этапе и, как они говорят, искоренить их, прежде чем они дойдут до того момента, когда они станут своего рода вышедшая из-под контроля эпидемия.
ПРИМЕЧАНИЕ РЕДАКТОРА. Это видео было изначально опубликовано в апреле 2020 года.
LoadingSomething is loading.Как коронавирус взламывает иммунную систему
Ранее на мышах исследователи идентифицировали гены, влияющие на успех трансплантации органов: они назвали этот набор генов основным комплексом гистосовместимости, или MHC, из греческого histos , для « ткань. » В шестидесятых была найдена человеческая версия MHC.Оказалось, что гены послужили образцом для замечательной системы, призванной отличать «я» от «чужого». Фрагменты белков, встроенных в наши клетки, загружаются на крошечные молекулярные плотики, которые доставляют их на поверхность клетки для проверки Т-клетками. Между тем, в тимусе Т-клетки обучаются в качестве инспекторов: им предоставляют плотики, содержащие фрагменты белка, некоторые из которых являются естественными для организма. Любая Т-клетка, которая игнорирует свой плот или начинает атаку в ответ на самогенерируемые фрагменты, уничтожается.Компетентные инспекторы отправляются на поиски посторонних материалов. Они ищут в своих плотах клетки, которые содержат незнакомые белковые части, и убивают их.
» В шестидесятых была найдена человеческая версия MHC.Оказалось, что гены послужили образцом для замечательной системы, призванной отличать «я» от «чужого». Фрагменты белков, встроенных в наши клетки, загружаются на крошечные молекулярные плотики, которые доставляют их на поверхность клетки для проверки Т-клетками. Между тем, в тимусе Т-клетки обучаются в качестве инспекторов: им предоставляют плотики, содержащие фрагменты белка, некоторые из которых являются естественными для организма. Любая Т-клетка, которая игнорирует свой плот или начинает атаку в ответ на самогенерируемые фрагменты, уничтожается.Компетентные инспекторы отправляются на поиски посторонних материалов. Они ищут в своих плотах клетки, которые содержат незнакомые белковые части, и убивают их.
Так выявляются и отторгаются кожные трансплантаты; как избавиться от зарождающегося рака; как искореняются клетки, захваченные вирусами. Вместе В-клетки и Т-клетки позволяют иммунной системе человека обновляться так же быстро, как наши клетки могут реплицироваться. Но их сила сопряжена с риском. Адаптивное оружие иммунной системы не всегда точно.От аллергии страдают от десяти до сорока процентов населения мира; до четырех процентов людей страдают изнурительными аутоиммунными заболеваниями. А паразиты могут найти способы взломать систему. «Изобретение приобретенного иммунитета было похоже на эскалацию войны с всемогущим противником», — пишет Хедрик, эксперт по Т-клеткам. Наше новое оружие может быть обращено против нас.
Но их сила сопряжена с риском. Адаптивное оружие иммунной системы не всегда точно.От аллергии страдают от десяти до сорока процентов населения мира; до четырех процентов людей страдают изнурительными аутоиммунными заболеваниями. А паразиты могут найти способы взломать систему. «Изобретение приобретенного иммунитета было похоже на эскалацию войны с всемогущим противником», — пишет Хедрик, эксперт по Т-клеткам. Наше новое оружие может быть обращено против нас.
К концу восьмидесятых уже не имело смысла противопоставлять клеточников и гуморалистов. Они оба были правы; просто они видели разные части иммунной системы в зависимости от того, куда и когда они смотрели.Фагоциты часто присутствовали в момент заражения. Антитела в крови, появление которых может занять несколько дней, преследовали захватчиков за пределами клеток организма, в то время как Т-клетки использовали MHC, чтобы заглянуть внутрь этих клеток, уничтожая те, которые были заражены вирусами или повреждены раком.
И все же загадки остались. На симпозиуме 1989 года иммунолог Чарльз Джейнвей описал то, что он назвал «маленьким грязным секретом»: вакцина, содержащая антиген, предназначенный для выработки антител, не будет работать, если не будет дополнительного раздражителя или «адъюванта» — обычно безвредного химического вещества или бактерии. — добавлено.Почему антигена было недостаточно, чтобы дать толчок созданию антител? «Честно говоря, ответ неизвестен», — сказала Джейнвей. Однако он подозревал, что этот процесс не может начаться, если врожденная иммунная система с ее интерферонами, цитокинами и эпителиальными клетками первой не забьет тревогу. Постоянная армия без приказов оставалась наготове.
На симпозиуме 1989 года иммунолог Чарльз Джейнвей описал то, что он назвал «маленьким грязным секретом»: вакцина, содержащая антиген, предназначенный для выработки антител, не будет работать, если не будет дополнительного раздражителя или «адъюванта» — обычно безвредного химического вещества или бактерии. — добавлено.Почему антигена было недостаточно, чтобы дать толчок созданию антител? «Честно говоря, ответ неизвестен», — сказала Джейнвей. Однако он подозревал, что этот процесс не может начаться, если врожденная иммунная система с ее интерферонами, цитокинами и эпителиальными клетками первой не забьет тревогу. Постоянная армия без приказов оставалась наготове.
Врожденная система должна предугадывать своих врагов — задача, которая кажется невыполнимой, учитывая их огромное разнообразие. Лишь примерно в 1997 году Джейнвей начала понимать, как такое ожидание может быть достигнуто.Примерно десятью годами ранее пара биологов по имени Кристиан Нюсслейн-Фольхард и Эрик Ф. Вишаус обнаружили ген, влияющий на развитие плодовых мух. Нюсслайн-Фольхард назвал его Толлем, используя немецкое слово, означающее «великий». (« Das ist ja toll! », — воскликнула она, сделав открытие.) Другой ученый, Жюль А. Хоффманн, узнал, что тот же ген участвует в иммунном ответе плодовой мухи; Джейнвей с помощью Руслана Меджитова показала, что его версия также присутствует у людей и используется в некоторых белых кровяных тельцах, которые являются первыми реагентами врожденной иммунной системы.В ходе экспериментов с человеческими клетками они показали, что ген кодирует то, что стало называться «Toll-подобным рецептором», который может распознавать определенный молекулярный мотив — строительный блок бактериальных мембран. Как будто эволюция заметила, что, хотя многие клетки строили свои дома из дуба или кирпича, опасные бактерии всегда использовали сосновую древесину. Почему бы не сделать детектор сосны?
Нюсслайн-Фольхард назвал его Толлем, используя немецкое слово, означающее «великий». (« Das ist ja toll! », — воскликнула она, сделав открытие.) Другой ученый, Жюль А. Хоффманн, узнал, что тот же ген участвует в иммунном ответе плодовой мухи; Джейнвей с помощью Руслана Меджитова показала, что его версия также присутствует у людей и используется в некоторых белых кровяных тельцах, которые являются первыми реагентами врожденной иммунной системы.В ходе экспериментов с человеческими клетками они показали, что ген кодирует то, что стало называться «Toll-подобным рецептором», который может распознавать определенный молекулярный мотив — строительный блок бактериальных мембран. Как будто эволюция заметила, что, хотя многие клетки строили свои дома из дуба или кирпича, опасные бактерии всегда использовали сосновую древесину. Почему бы не сделать детектор сосны?
Иммунологи вскоре открыли второй Toll-подобный рецептор, затем третий; они начали давать им имена вроде TLR4 и TLR5.Были обнаружены целые новые семейства «рецепторов распознавания образов». Каждый рецептор, изобретательный по своей конструкции, распознавал некоторую характерную микробную или вирусную сигнатуру — излом в РНК вируса, зазубрину в стенке микробной клетки.
Каждый рецептор, изобретательный по своей конструкции, распознавал некоторую характерную микробную или вирусную сигнатуру — излом в РНК вируса, зазубрину в стенке микробной клетки.
Наконец-то появилась четкая картина всей системы. Все было взаимосвязано. Врожденный иммунитет запускает иммунный ответ, поскольку клетки в очаге инфекции используют свои рецепторы для распознавания захватчиков и борьбы с ними, а также выделяют интерфероны и цитокины, чтобы поднять тревогу.На это реагируют различные типы лейкоцитов, которые попадают в инфекцию через кровоток. Они идентифицируют и поедают чужеродные клетки, возвращая переваренные частицы через лимфатические узлы в тимус и костный мозг в виде информации. В последующие дни антитела и Т-клетки-киллеры — оружие адаптивного иммунитета — будут созданы в соответствии со спецификациями. Все играет двойную или тройную роль. Например, антитела не просто прикрепляются к захватчикам, чтобы блокировать их проникновение в клетки; они также помечают их, чтобы лейкоцитам было легче их найти и съесть. Врожденные и адаптивные руки усиливают разрушительные способности друг друга.
Врожденные и адаптивные руки усиливают разрушительные способности друг друга.
Здесь снова Хедрик предостерегает. «Такая схема должна беспокоить любого системного аналитика», — пишет он. «Потенциально смертельный механизм, управляемый положительной обратной связью, — это рецепт безудержного разрушения».
В конце марта 32-летний мужчина голландского происхождения был госпитализирован в больницу в Нидерландах. Ему было трудно дышать, и компьютерная томография показала, что в его легких распространяется непрозрачная дымка.Ему поставили диагноз COVID -19, и он провел шестнадцать дней в реанимации; Через четыре дня после того, как он был переведен из I.C.U., у него произошло коллапсирование одного из легких. Он достаточно поправился, чтобы его отправили домой девять дней спустя. Его двадцатидевятилетний брат, живший в другом доме, заболел примерно в то же время и умер. У их родителей были умеренные симптомы.
Когда ученые узнали, что вторая пара молодых братьев — двадцати одного и двадцати трех лет, африканского происхождения — также перенесли тяжелые случаи COVID -19, они попытались изучить всех четырех мужчин.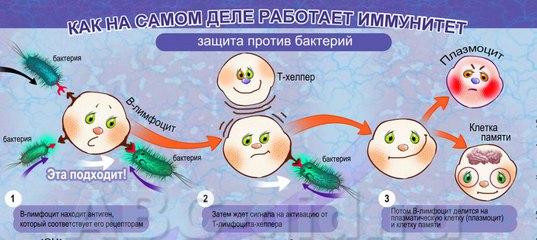 Секвенируя геномы мужчин и их родителей, исследователи надеялись найти аномалию, которая могла бы объяснить, почему у некоторых молодых людей, особенно мужчин, были такие плохие результаты.
Секвенируя геномы мужчин и их родителей, исследователи надеялись найти аномалию, которая могла бы объяснить, почему у некоторых молодых людей, особенно мужчин, были такие плохие результаты.
Голландская группа обнаружила нечто, перекликающееся с теорией ТенОуэра о том, как SARS -CoV-2 перестраивает сотовую систему сигнализации. У всех четырех мужчин был неэффективный вариант TLR7, Toll-подобного рецептора, который распознает вирусную РНК. Когда это работает, TLR7 помогает производить интерфероны, которые говорят соседним клеткам усилить свои противовирусные действия.Когда этого не происходит, сигнал тревоги не включается, и инфекция распространяется. Эта генетическая аномалия значительно облегчила работу вируса. Рейдеры подошли к незапертому дому.
«Это противоречит нашему здравому смыслу, но мы напишем об этом, чтобы вы могли оставить свой маленький пистолет». Карикатура Фрэнка Котэма Этой весной клинические испытания в Великобритании дали интерферон-бета, синтетическую версию молекулы, на случайную выборку из ста и одного пациента, госпитализированного с COVID -19. Испытание показало, что у тех, кто получил интерферон на ранней стадии заражения, вероятность серьезного заболевания на семьдесят девять процентов ниже. Исследователи согласны с тем, что время имеет решающее значение. В первые дни коронавирусной инфекции повышение уровня интерферона может помочь вашей врожденной иммунной системе сдержать вирус. Позже, однако, это может быть вредно; в этот момент ваша адаптивная иммунная система может уже выйти из-под контроля, и вам может потребоваться иммунодепрессант, такой как стероид дексаметазон. (В прошлом месяце президент Трамп получил дексаметазон в рамках лечения от COVID -19; ему также дали лекарство, которое содержало лабораторно сконструированные антитела, способные бороться с вирусом наряду или опережая собственную адаптивную реакцию его организма.)
Испытание показало, что у тех, кто получил интерферон на ранней стадии заражения, вероятность серьезного заболевания на семьдесят девять процентов ниже. Исследователи согласны с тем, что время имеет решающее значение. В первые дни коронавирусной инфекции повышение уровня интерферона может помочь вашей врожденной иммунной системе сдержать вирус. Позже, однако, это может быть вредно; в этот момент ваша адаптивная иммунная система может уже выйти из-под контроля, и вам может потребоваться иммунодепрессант, такой как стероид дексаметазон. (В прошлом месяце президент Трамп получил дексаметазон в рамках лечения от COVID -19; ему также дали лекарство, которое содержало лабораторно сконструированные антитела, способные бороться с вирусом наряду или опережая собственную адаптивную реакцию его организма.)
Гены TLR7 находятся на сцепленной с полом Х-хромосоме. Это может быть частичным объяснением того, почему мужчины страдают от тяжелого заболевания COVID -19 чаще, чем женщины. Но дефицит TLR7, вероятно, будет редкостью — гораздо реже, чем частота случаев тяжелого COVID -19 среди молодых людей. Почти наверняка существуют другие генетические факторы или факторы окружающей среды, которые ослабляют реакцию на интерферон. В середине сентября исследование, опубликованное в журнале Science , показало, что около пациентов с COVID -19 с плохими исходами имели «аутоантитела», атакующие их собственный интерферон; в другой статье, опубликованной в том же номере, описан генетический недостаток, связанный с TLR3, который также участвует в реакции на интерферон.(Целых четырнадцать процентов тяжелых случаев COVID -19 могут быть связаны с одним из этих двух состояний.) Чем больше исследователей изучают наш иммунный ответ на вирус, тем сложнее они обнаруживают. Согласно некоторым теориям, как обстоят дела у вас может зависеть от того, сколько вирусных частиц вы вдохнули, и от того, достигают ли они ваших легких, когда вы их вдыхаете. Если вы недавно простудились, возможно, что Т-клетки Вы, разработанные для борьбы с ним, могли частично соответствовать коронавирусу.
Но дефицит TLR7, вероятно, будет редкостью — гораздо реже, чем частота случаев тяжелого COVID -19 среди молодых людей. Почти наверняка существуют другие генетические факторы или факторы окружающей среды, которые ослабляют реакцию на интерферон. В середине сентября исследование, опубликованное в журнале Science , показало, что около пациентов с COVID -19 с плохими исходами имели «аутоантитела», атакующие их собственный интерферон; в другой статье, опубликованной в том же номере, описан генетический недостаток, связанный с TLR3, который также участвует в реакции на интерферон.(Целых четырнадцать процентов тяжелых случаев COVID -19 могут быть связаны с одним из этих двух состояний.) Чем больше исследователей изучают наш иммунный ответ на вирус, тем сложнее они обнаруживают. Согласно некоторым теориям, как обстоят дела у вас может зависеть от того, сколько вирусных частиц вы вдохнули, и от того, достигают ли они ваших легких, когда вы их вдыхаете. Если вы недавно простудились, возможно, что Т-клетки Вы, разработанные для борьбы с ним, могли частично соответствовать коронавирусу. Уровень витамина D может иметь значение, потому что витамин D помогает контролировать воспаление. Вредные аутоантитела могут быть причиной стойких симптомов, от которых страдают COVID -19 «дальнобойщики». Все это все еще исследуется.
Уровень витамина D может иметь значение, потому что витамин D помогает контролировать воспаление. Вредные аутоантитела могут быть причиной стойких симптомов, от которых страдают COVID -19 «дальнобойщики». Все это все еще исследуется.
Иммунная система использует обратную связь, чтобы оставаться в равновесии, как гимнастка на бревне. Если подует легкий ветерок, гимнастка может немного раскачиваться; почувствовав это, она перенесет свой вес, чтобы вернуться в центр. Но при достаточно сильном толчке она склонна перескакивать со своей реакцией и, с другой стороны, снова перескакивать, пока не упадет.Многие факторы способствуют скольжению — напряженный сгибатель бедра, напряженная икра, влажность в воздухе — все они усиливают силу толчка.
Гимнастки старшего возраста обычно менее подвижны. То же самое и с иммунной системой, поэтому COVID -19 непропорционально поражает пожилых людей. И без того высокий уровень смертности среди детей в возрасте от шестидесяти пяти до семидесяти четырех лет более чем втрое выше среди людей семидесяти пяти лет и старше. Такое возрастное распределение уникально для коронавируса. Дети более подвержены сезонному гриппу; Дети и молодые люди, заболевшие свиным гриппом в 2009 году, были госпитализированы чаще всего, в то время как пандемический грипп 1918 года сильнее всего поразил взрослых в возрасте от двадцати до тридцати лет.(Возможно, их иммунная система слишком остро отреагировала, или пожилые люди приобрели иммунитет к аналогичным штаммам.) «Разница в риске и профиле, молодые и старые — я не думаю, что кто-то раньше видел, чтобы инфекционный агент вел себя подобным образом», — Ричард Ходс , сказал директор Национального института старения при Национальных институтах здравоохранения, о коронавирусе.
Такое возрастное распределение уникально для коронавируса. Дети более подвержены сезонному гриппу; Дети и молодые люди, заболевшие свиным гриппом в 2009 году, были госпитализированы чаще всего, в то время как пандемический грипп 1918 года сильнее всего поразил взрослых в возрасте от двадцати до тридцати лет.(Возможно, их иммунная система слишком остро отреагировала, или пожилые люди приобрели иммунитет к аналогичным штаммам.) «Разница в риске и профиле, молодые и старые — я не думаю, что кто-то раньше видел, чтобы инфекционный агент вел себя подобным образом», — Ричард Ходс , сказал директор Национального института старения при Национальных институтах здравоохранения, о коронавирусе.
Односторонность вируса означает, что вакцины могут быть не столь эффективны для пожилых пациентов, даже при двойной дозе или после повторных прививок.Прелесть вакцины в том, что она избавляет нас от задачи полного понимания вируса; его пакет антигенов просто нажимает кнопку включения великой машины. Помощь пожилым людям может потребовать более тонкого подхода, адаптированного к конкретному способу, которым этот вирус дестабилизирует иммунную систему. То, что мы узнали до сих пор, предполагает, что дело не только в том, что старение делает вас слабыми, и что COVID -19 использует эту слабость; Механизм действия болезни фактически усиливается в стареющем организме.
Помощь пожилым людям может потребовать более тонкого подхода, адаптированного к конкретному способу, которым этот вирус дестабилизирует иммунную систему. То, что мы узнали до сих пор, предполагает, что дело не только в том, что старение делает вас слабыми, и что COVID -19 использует эту слабость; Механизм действия болезни фактически усиливается в стареющем организме.
По этой причине, примерно через месяц после начала расследования коронавируса, исследователи лаборатории tenOever переключились с хорьков на хомяков. Иммунная система хорька очень отзывчива, и животные слишком быстро поправлялись. «Они больше похожи на детей», — сказал tenOever. Напротив, у некоторых хомяков при заражении вирусом «действительно развивается респираторный дистресс. Мы видим гораздо больше инфильтрации в их легких ». У пожилых хомяков, как и у пожилых людей, врожденный иммунитет с меньшей вероятностью содержит вирус, а адаптивный иммунитет медленнее включается и выключается.У хомяка резко нарушается регуляция. «Разница между этими двумя результатами действительно сводится к тому, что с возрастом …» ТенОвер сделал паузу. «Стареть — отстой. Все ломается, даже на простейшем уровне ».
«Разница между этими двумя результатами действительно сводится к тому, что с возрастом …» ТенОвер сделал паузу. «Стареть — отстой. Все ломается, даже на простейшем уровне ».
С возрастом наша иммунная система укрепляется. «Если бы мне пришлось отреагировать на оскорбление — бактерии, вирус, травму, поражение, — ответ был бы более медленным и менее сильным», — сказал Луиджи Ферруччи, изучающий процесс старения и иммунную систему в Национальном институте старения. скажи мне.Но при этом система становится хронически активированной. Цитокины циркулируют в крови на постоянном высоком уровне, как если бы организм все время отвечал на некоторую атаку. Это верно независимо от здоровья. «Даже у людей, которые очень здоровы, очень хорошо питаются, не болеют и не принимают лекарств, есть некоторые воспалительные маркеры, концентрация которых увеличивается с возрастом», — сказал Ферруччи. Подумайте о рубце, который поднимается от укуса, а затем представьте тот же процесс — опухоль, покраснение, жесткость, скопление гноя — медленно проникающий по всему телу. Уровень воспаления влияет на ваш «биологический» возраст — который не всегда идеально совпадает с вашим хронологическим возрастом — и увеличивает риск развития сердечно-сосудистых заболеваний, рака и слабоумия; это способствует тому, что гериатры называют «слабостью».
Уровень воспаления влияет на ваш «биологический» возраст — который не всегда идеально совпадает с вашим хронологическим возрастом — и увеличивает риск развития сердечно-сосудистых заболеваний, рака и слабоумия; это способствует тому, что гериатры называют «слабостью».
Явление, известное как клеточное старение, частично отвечает за усиление воспаления в организме с течением времени. По мере того как клетки стареют и делятся, в их ДНК нарастают небольшие ошибки. Эти ошибки могут привести к раку среди других болезней.Так клетки сами себя контролируют. Когда они обнаруживают распад в своей ДНК, они прекращают репликацию и начинают выделять цитокины, как будто прося иммунную систему проверить и уничтожить их. Накопление стареющих клеток может способствовать серьезному развитию COVID -19: согласно нынешней теории, по словам Ферруччи, они могут «значительно расширить цитокиновый шторм», при котором неконтролируемая петля обратной связи приводит к внезапному всплеску воспаления по всему телу. .
.
Адаптация вируса летучих мышей может объяснить распространение видов, говорят исследователи — ScienceDaily
Исследовательская группа Университета Саскачевана (США) выяснила, как летучие мыши могут переносить коронавирус ближневосточного респираторного синдрома (MERS), не заболевая — исследование, которое могло пролить свет на то, как коронавирусы проникают в людей и других животных.
Коронавирусы, такие как MERS, тяжелый острый респираторный синдром (SARS), а в последнее время и вирус SARS-CoV-2, вызывающий COVID19, предположительно произошли от летучих мышей. Хотя эти вирусы могут вызывать серьезные и часто смертельные заболевания у людей, по причинам, ранее не понятным, летучие мыши кажутся невредимыми.
«Летучие мыши не избавляются от вируса и при этом не болеют. Мы хотели понять, почему вирус MERS не подавляет иммунные реакции летучих мышей, как это происходит у людей», — сказал американский микробиолог Викрам Мисра.
В исследовании, только что опубликованном в Scientific Reports , команда впервые продемонстрировала, что клетки коричневой летучей мыши, поедающей насекомых, могут постоянно инфицироваться коронавирусом MERS в течение нескольких месяцев из-за важных адаптаций как летучей мыши, так и действующего вируса. вместе.
вместе.
«Вместо того, чтобы убивать клетки летучей мыши, как вирус убивает человеческие клетки, коронавирус MERS вступает в долгосрочные отношения с хозяином, поддерживаемые уникальной« супер »иммунной системой летучей мыши», — сказал Мисра, автор статьи.«Считается, что SARS-CoV-2 действует таким же образом».
Мисра говорит, что работа команды предполагает, что стрессы для летучих мышей — такие как влажные рынки, другие болезни и, возможно, потеря среды обитания — могут иметь роль в распространении коронавируса на другие виды.
«Когда летучая мышь испытывает стресс для своей иммунной системы, это нарушает баланс между иммунной системой и вирусом и позволяет вирусу размножаться», — сказал он.
Исследование было проведено в Международном центре вакцин (VIDO-InterVac), Международном центре вакцин (VIDO-InterVac), Международном центре вакцин (VIDO-InterVac), одном из крупнейших в мире исследовательских центров третьего уровня содержания, группой исследователей из Западного колледжа ветеринарной медицины USask и VIDO- InterVac.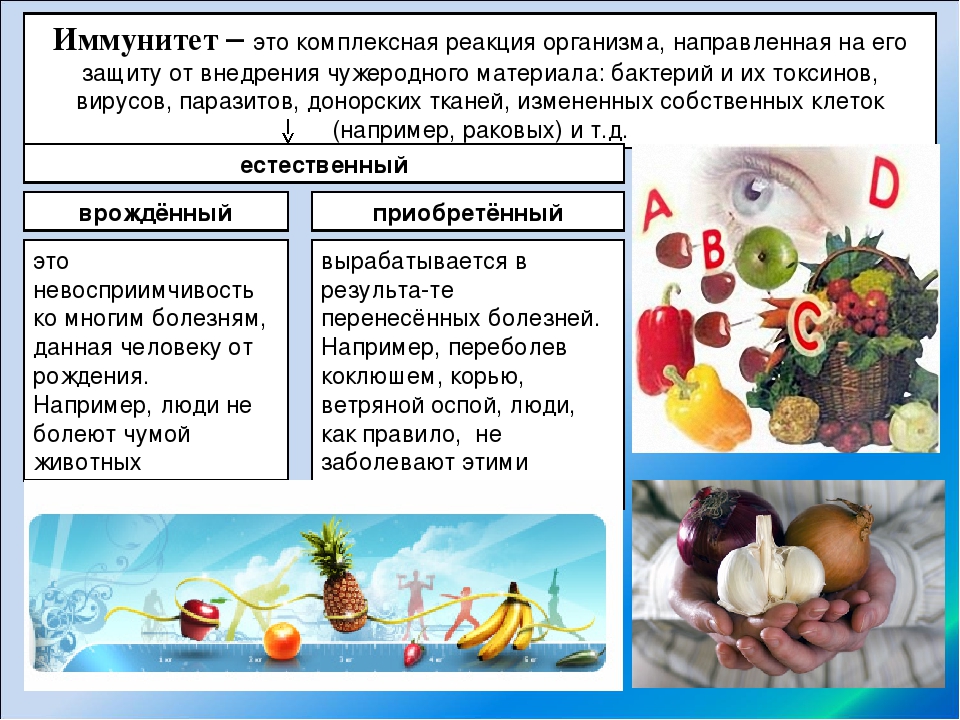
«Мы видим, что коронавирус MERS может очень быстро адаптироваться к определенной нише, и, хотя мы не полностью понимаем, что происходит, это демонстрирует, как коронавирусы могут легко переходить от вида к виду», — говорится в сообщении VIDO-InterVac. ученый Дэррил Фалзарано, который руководил исследованием летучих мышей, разработал первое потенциальное лекарство от БВРС-КоВ и возглавляет усилия VIDO-InterVac по разработке вакцины против COVID-19.
На данный момент вирусом SARS-CoV-2 заразилось более 3 человек.5 миллионов человек во всем мире и убили семь процентов инфицированных. Напротив, вирус MERS заразил почти 2500 человек в 2012 году, но убил каждого третьего инфицированного человека. Вакцины против SARS-CoV-2 или MERS нет. Хотя верблюды являются известными промежуточными хозяевами БВРС-КоВ, летучие мыши считаются предковыми хозяевами.
Коронавирусы быстро адаптируются к видам, которые они заражают, сказал Мисра, но мало что известно о молекулярных взаимодействиях этих вирусов с их естественными хозяевами летучими мышами. Исследование, проведенное под руководством США в 2017 году, показало, что коронавирусы летучих мышей могут сохраняться в естественных носителях летучих мышей в течение как минимум четырех месяцев спячки.
Исследование, проведенное под руководством США в 2017 году, показало, что коронавирусы летучих мышей могут сохраняться в естественных носителях летучих мышей в течение как минимум четырех месяцев спячки.
При воздействии вируса MERS клетки летучих мышей адаптируются — не за счет производства белков, вызывающих воспаление, которые являются признаком заболевания, а за счет поддержания естественного противовирусного ответа — функции, которая отключается у других видов, включая человека. Одновременно вирус MERS также адаптируется к клеткам-хозяевам летучих мышей, очень быстро мутируя один конкретный ген, сказал он.
Действуя вместе, эти адаптации приводят к тому, что вирус остается в летучей мыши надолго, но становится безвредным до тех пор, пока что-то — например, болезнь или другие факторы стресса — не нарушит это хрупкое равновесие.
Затем команда сосредоточится на понимании того, как переносимый летучими мышами вирус MERS адаптируется к инфекции и репликации у верблюдовых (группа копытных животных, в которую входят верблюды) и клеток человека.
«Эта информация может иметь решающее значение для прогнозирования следующего вируса летучих мышей, который вызовет пандемию», — сказал Мисра.
Ведущими исследователями этой статьи были бывшие аспиранты Мисры Аринджай Банерджи и Сону Субудхи, которые сейчас находятся в Университете Макмастера и Массачусетской больнице общего профиля соответственно. Среди других членов команды были исследователи Норин Рапин и Джоселин Лью, а также летняя студентка Рича Джайн.
прыгунов | The Scientist Magazine®
Mirabilis jalapa (четырехчасовой цветок) является хозяином Phytophthora mirabilis , родственного вида ирландскому возбудителю картофельного голода Phytophthora infestans .ПРЕДОСТАВЛЕНИЕ СОФИЕНА КАМУНА Грибоподобный патоген Phytophthora infestans и родственные ему виды, Phytophthora mirabilis , заражают различные виды растений. P. infestans — виновник ирландского картофельного голода в XIX веке, в результате которого погиб около 1 миллиона человек и был вынужден покинуть страну еще один миллион — заражает картофель, помидоры и других членов семейства Solanaceae, а P. mirabilis поражает исключительно четырехчасовое растение ( Mirabilis jalapa ).Согласно исследованию, опубликованному сегодня (30 января) в журнале Science , вклад в специализацию хозяина этих патогенов вносит изменение одной аминокислоты в эффекторном белке, который связывает и ингибирует защиту протеазы растений.
mirabilis поражает исключительно четырехчасовое растение ( Mirabilis jalapa ).Согласно исследованию, опубликованному сегодня (30 января) в журнале Science , вклад в специализацию хозяина этих патогенов вносит изменение одной аминокислоты в эффекторном белке, который связывает и ингибирует защиту протеазы растений.
«Это очень сильная статья в том смысле, что она четко связывает биохимию с эволюцией в целом», — сказал молекулярный завод.
«Работа отличная и важная», — Брюс Макдональд, патолог из Института растений. Интегративная биология из Цюриха, Швейцария, сообщила изданию The Scientist по электронной почте.«[Это] редкая иллюстрация молекулярных изменений, лежащих в основе адаптации патогенов в естественных и сельскохозяйственных экосистемах».
В 2010 году Камун, патолог растений из лаборатории Сейнсбери в Великобритании, и его коллеги сравнили геномы P. infestans и P. mirabilis и нашли доказательства адаптивной эволюции у каждого из двух видов, которые раскололись около 1300 лет назад. Они идентифицировали в общей сложности 345 генов, имеющих признаки положительного отбора, включая 82 эффекторных гена, продукты которых взаимодействуют с молекулами-мишенями хозяина, чтобы способствовать инфекции.
Они идентифицировали в общей сложности 345 генов, имеющих признаки положительного отбора, включая 82 эффекторных гена, продукты которых взаимодействуют с молекулами-мишенями хозяина, чтобы способствовать инфекции.
В новом исследовании команда Камуна более подробно рассматривает один из этих эффекторов, цистатиноподобный ингибитор протеазы EPIC1, который нацелен на защитные протеазы хозяина. Сначала исследователи протестировали взаимодействия каждой версии эффектора патогена — EPIC1 в P. infestans и PmEPIC1 в P. mirabilis — с белками их собственных растений и растений-хозяев друг друга и обнаружили, что эффекторы сильнее связываются с протеазами. от их собственного вида-хозяина. EPIC1 был гораздо лучшим ингибитором папаинподобной цистеиновой протеазы RCR3 из томатов ( Solanum lycopersicum ) и трех видов дикого картофеля, чем PmEPIC1; PmEPIC1 был более эффективным, чем EPIC1, в ингибировании M.japana протеаза Mirabilis RCR3-подобная протеаза 2 (MRP2).
«Таким образом, эффекторы EPIC1 функционируют более эффективно на своих соответствующих хозяевах, подтверждая гипотезу о специализации эффекторов после скачка», — написала Гитта Коакер, патолог растений из Калифорнийского университета в Дэвисе, в перспективе, прилагаемой к статье.
«Мы знаем, что эти патогены эволюционировали в результате прыжков хозяина. . . поэтому вы ожидаете, что эти взаимодействующие и связывающиеся эффекторы внезапно столкнутся с разными белками », — сказал Камун.«Этот [результат] действительно согласуется с той гипотезой, что после скачка хозяина эффекторы будут развиваться».
Для дальнейшего изучения биохимической основы, которая позволила эффекторным белкам патогенов специфически связываться с белками их собственных видов хозяев, Камун и его коллеги сравнили аминокислотные последовательности эффекторных белков EPIC1 от двух патогенов, а также от хозяина. протеазы их хозяев, и обнаружили одно аминокислотное различие в каждом, что в значительной степени объясняет специфичность.
«В этом случае одно из специфических аминокислотных изменений, ответственных за адаптацию старого патогена к новому хозяину, было выявлено и тщательно задокументировано», — сказал Макдональд.
«Эти открытия открывают новые захватывающие двери для понимания роли эффекторов в формировании адаптации патогенов», — писал Коакер. «Консервированные основные эффекторы, прошедшие положительный отбор, могут быть многообещающими мишенями для борьбы с болезнями. Способность природы выбирать биохимическую специализацию имеет значение для инженерных ферментов и соответствующих им мишеней для повышения специфичности.
Результаты также подтверждают идею о том, что специализированные патогены сталкиваются с компромиссом, сказал Камун: когда они адаптируются к новому хозяину, они теряют способность заразить своего бывшего хозяина. Таким образом, было бы интересно изучить адаптивную эволюцию более универсальных патогенов, которые инфицируют различные виды хозяев, отметил Хайтема. «Это вопрос, который я считаю открытым».
«Это одна из тех статей, в которых вы понимаете, как много мы должны узнать о влиянии эволюции генома на патогены растений и какова биохимическая основа этого», — сказал Хайтема.«Я думаю, что это отличный дегустатор для многих других захватывающих открытий, которые еще впереди».
С. Донг и др., «Эффекторная специализация в линии ирландского патогена картофельного голода», Science , 343: 552-5, 2014.
Метаболиты, модулируемые микробиомом, на стыке иммунитета хозяина
Введение
Микробиом кишечника — это микробная экосистема, которая оказывает разнообразное воздействие на физиологические функции хозяина, в частности, на развитие и активность иммунной системы.Молекулярная основа взаимодействий хозяина и микробиома только начинает разгадываться и опосредуется как межклеточными взаимодействиями, так и производством, модификацией и восприятием большого количества биоактивных малых молекул, называемых метаболитами. Многие метаболиты желудочно-кишечного тракта происходят из пищевых источников или из окружающей среды. Они сталкиваются с микробиомом кишечника в процессе пищеварения и кишечного транзита и связывают питание хозяина с физиологией, включая развитие и функцию иммунной системы.И наоборот, пищевой состав сильно влияет на микробный состав и функцию кишечника (1). Другие метаболиты эндогенно продуцируются или модифицируются посредством различных метаболических процессов хозяином или его микробиотой (2). В совокупности, по оценкам, более 50% метаболитов фекалий и мочи получают из кишечного микробиома или модифицируются им (3).
Они сталкиваются с микробиомом кишечника в процессе пищеварения и кишечного транзита и связывают питание хозяина с физиологией, включая развитие и функцию иммунной системы.И наоборот, пищевой состав сильно влияет на микробный состав и функцию кишечника (1). Другие метаболиты эндогенно продуцируются или модифицируются посредством различных метаболических процессов хозяином или его микробиотой (2). В совокупности, по оценкам, более 50% метаболитов фекалий и мочи получают из кишечного микробиома или модифицируются им (3).
Некоторые метаболиты, связанные с микробиомом, являются биоактивными и влияют на клеточные процессы хозяина, включая дифференциацию, миграцию, пролиферацию и апоптоз, тем самым оказывая плеотропные физиологические или патофизиологические эффекты на эукариотического хозяина.Ряд метаболитов влияет на созревание и функцию слизистых оболочек и системного иммунитета в устойчивом состоянии и во время болезни (4–8). Хозяин развил множественные платформы для восприятия метаболитов и нижестоящие иммунные сигнальные пути, которые придают реактивность метаболитам, модулируемым микробиомом (9, 10). Эти сенсорные платформы экспрессируются в различных комбинациях в клеточных субпопуляциях слизистой оболочки, таких как кишечные эпителиальные клетки, макрофаги, дендритные клетки (DC), Т-клетки и врожденные лимфоидные клетки (ILC), где они играют критическую роль в мутуалистическом перекрестном взаимодействии микробиома хозяина разговаривать.Помимо местного воздействия метаболитов на иммунную функцию слизистой оболочки желудочно-кишечного тракта, многие системно абсорбируемые метаболиты могут достигать удаленных органов и модулировать иммунные ответы в стерильных областях хозяина, таких как ЦНС (11, 12). Таким образом, метаболиты могут обеспечивать недостающую связь между составом и функциональной конфигурацией микробиома кишечника с его отдаленными эффектами на физиологию хозяина и риск заболевания в, казалось бы, несвязанных стерильных органах. Тип, состав и концентрация метаболитов в сочетании с репертуаром сенсорных молекул хозяина регулируют общий физиологический ответ в данном физиологическом контексте.
Эти сенсорные платформы экспрессируются в различных комбинациях в клеточных субпопуляциях слизистой оболочки, таких как кишечные эпителиальные клетки, макрофаги, дендритные клетки (DC), Т-клетки и врожденные лимфоидные клетки (ILC), где они играют критическую роль в мутуалистическом перекрестном взаимодействии микробиома хозяина разговаривать.Помимо местного воздействия метаболитов на иммунную функцию слизистой оболочки желудочно-кишечного тракта, многие системно абсорбируемые метаболиты могут достигать удаленных органов и модулировать иммунные ответы в стерильных областях хозяина, таких как ЦНС (11, 12). Таким образом, метаболиты могут обеспечивать недостающую связь между составом и функциональной конфигурацией микробиома кишечника с его отдаленными эффектами на физиологию хозяина и риск заболевания в, казалось бы, несвязанных стерильных органах. Тип, состав и концентрация метаболитов в сочетании с репертуаром сенсорных молекул хозяина регулируют общий физиологический ответ в данном физиологическом контексте.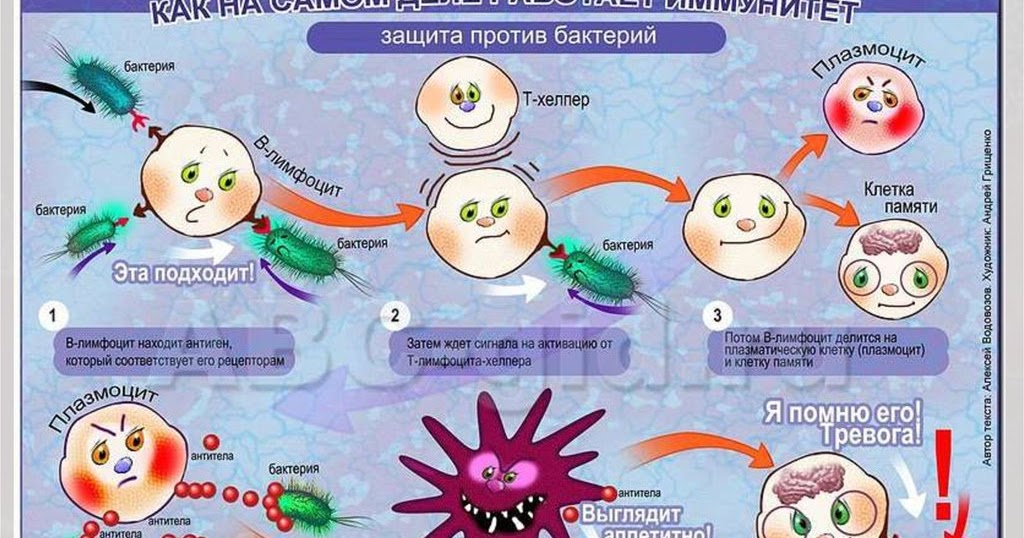
В этом обзоре мы представляем обзор метаболитов, модулируемых микробиомом кишечника, их физиологическое влияние на основные иммунные функции и недавние наблюдения, которые, возможно, связывают дисбаланс метаболитов с риском иммуноопосредованных и иммуноассоциированных заболеваний.
Модуляция микробиомом конфигурации метаболитов желудочно-кишечного тракта
Одна из основных функций, обеспечиваемых микробиотой кишечника, включает модуляцию метаболитов желудочно-кишечного тракта, включая их синтез, пищеварение, ферментацию и вторичный метаболизм.Многочисленные исследования изучали силы, которые управляют развитием взрослой микробной популяции в кишечнике с момента рождения (13, 14), однако динамика воздействия микробиома на метаболом хозяина остается в значительной степени неизвестной. Центральная роль микробной активности в формировании метаболома кишечника демонстрируется глубокими изменениями метаболитов, обнаруженными у свободных от микробов животных по сравнению с гнотобиотическими и колонизированными животными, включая различия в различных биохимических группах метаболитов, отмеченные в кале, моче и системном кровотоке (15–18).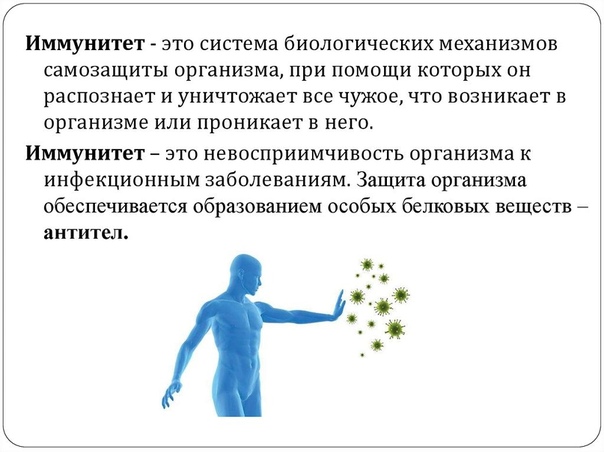 ).Было показано, что множество комменсальных микробных таксономий, включая Enterobacteriaceae , Enterococus spp. И Lactobacillus spp., Влияют на концентрацию метаболитов в желудочно-кишечном тракте (17) посредством процессов, охватывающих от использования аминокислот в качестве источника азота до побочного продукта. образование вторичных метаболитов, таких как жирные кислоты с короткой цепью (SCFA). В следующем разделе мы выделим ключевые примеры этих эффектов микробиома на диетические и эндогенно генерируемые метаболиты кишечника, а также то, как эти эффекты микробиома влияют на последующие эффекторные функции этих метаболитов на иммунитет хозяина (рис.1, 2).
).Было показано, что множество комменсальных микробных таксономий, включая Enterobacteriaceae , Enterococus spp. И Lactobacillus spp., Влияют на концентрацию метаболитов в желудочно-кишечном тракте (17) посредством процессов, охватывающих от использования аминокислот в качестве источника азота до побочного продукта. образование вторичных метаболитов, таких как жирные кислоты с короткой цепью (SCFA). В следующем разделе мы выделим ключевые примеры этих эффектов микробиома на диетические и эндогенно генерируемые метаболиты кишечника, а также то, как эти эффекты микробиома влияют на последующие эффекторные функции этих метаболитов на иммунитет хозяина (рис.1, 2).
Метаболиты, связанные с микробиотой, формируют иммунитет слизистой оболочки. Метаболиты участвуют в сложной сети коммуникаций между хозяином и микробиомом, управляя иммунными ответами. Предполагается, что наиболее хорошо изученные метаболиты SCFA и NA влияют на несколько аспектов иммунного ответа, такие как функция макрофагов и DC и секреция цитокинов, дифференцировка Treg, секреция муцина бокаловидными клетками кишечника, активация IL-18, опосредованная инфламмасомами, и хемотаксис нейтрофилов.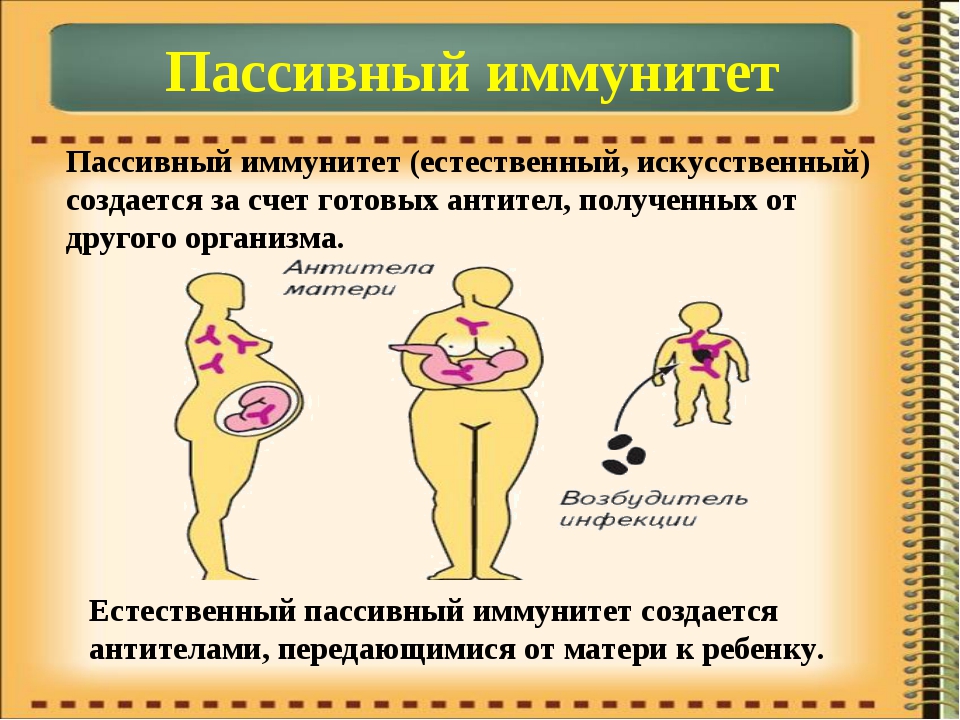 через путь NF-κB.
через путь NF-κB.
Влияние желчной кислоты на интерфейс хозяин-микробиота и иммунные функции. Желчные кислоты вырабатываются печенью, секретируются в проксимальный отдел тонкой кишки и регулируются микробиомом, тем самым влияя на множество иммунных процессов. Желчные кислоты связывают FXR на эпителиальных клетках кишечника, посредством чего они регулируют целостность барьера и структуру бактериального сообщества. В макрофагах передача сигналов желчной кислоты подавляет NF-κB-контролируемые провоспалительные реакции. Метаболит желчной кислоты таурин формирует интерфейс хозяин-микробиота посредством активации передачи сигналов воспаления Nlrp6 , что приводит к секреции IL-18 эпителиальными клетками кишечника и последующей модуляции транскрипции антимикробного пептида.Гистамин и спермин отрицательно модулируют инфламмасому Nlrp6.
Производство метаболитов микробиомом De novo.
Микробиота кишечника продуцирует ряд метаболитов, некоторые из которых обладают определенными биоактивными функциями на эукариотическом хозяине. Ярким примером таких синтезированных de novo метаболитов являются SCFAs, которые являются продуктами микробной ферментации неперевариваемых пищевых волокон, и включают ацетат (C2), пропионат (C3) и бутират (C4). Кишечные комменсальные бактерии, например, принадлежащие к родам Butyrivibrio , Clostridium и Eubacterium , могут продуцировать SCFAs, которые локально достигают миллимолярной концентрации (19).Дополнительные побочные продукты ферментации, такие как сукцинат и лактат, также образуются во время производства SCFA и используются микробиотой для поддержания и выживания (20). SCFAs, в свою очередь, опосредуют ряд важных функций эукариотического хозяина, включая использование в качестве источника энергии эпителиальными клетками кишечника, а также различные противовоспалительные свойства Т-лимфоцитов, регуляторных Т-клеток (Treg), нейтрофилов и макрофагов. , где они влияют на миграцию, цитолитическую активность, продукцию цитокинов и эпигенетическую регуляцию экспрессии генов (обсуждается ниже).
Ярким примером таких синтезированных de novo метаболитов являются SCFAs, которые являются продуктами микробной ферментации неперевариваемых пищевых волокон, и включают ацетат (C2), пропионат (C3) и бутират (C4). Кишечные комменсальные бактерии, например, принадлежащие к родам Butyrivibrio , Clostridium и Eubacterium , могут продуцировать SCFAs, которые локально достигают миллимолярной концентрации (19).Дополнительные побочные продукты ферментации, такие как сукцинат и лактат, также образуются во время производства SCFA и используются микробиотой для поддержания и выживания (20). SCFAs, в свою очередь, опосредуют ряд важных функций эукариотического хозяина, включая использование в качестве источника энергии эпителиальными клетками кишечника, а также различные противовоспалительные свойства Т-лимфоцитов, регуляторных Т-клеток (Treg), нейтрофилов и макрофагов. , где они влияют на миграцию, цитолитическую активность, продукцию цитокинов и эпигенетическую регуляцию экспрессии генов (обсуждается ниже).
Другим примером биологически активных метаболитов, синтезируемых микробами de novo, являются витамины, небольшие биоактивные питательные вещества, которые извлекаются из рациона и могут регулироваться микробиомом или de novo, продуцируемыми кишечными комменсалами. Одним из таких важных примеров является витамин К, центральный кофактор, регулирующий каскад свертывания крови у млекопитающих (21) и иммунитет (22). Группа витамина К состоит из витамина К1 (филлохинон), полученного с пищей, и витамина К2 (менахинон), который также может вырабатываться из витамина К1 большинством видов кишечной микробиоты, включая Enterobacter sp., Eubacterium lentum , Veillonella sp. и Bacteroides sp (23). Члены группы витамина К всасываются в тонком кишечнике в процессе, требующем солей желчных кислот (24). Важность микробного производства витамина К для его общего кишечного пула подтверждается тем фактом, что лечение антибиотиками широкого спектра действия вызывает значительное снижение уровня витамина К (25). Более того, животная модель с первичным дефицитом витамина К не была успешно создана с использованием только витамин К-дефицитной диеты, если в процессе не использовались стерильные мыши, что еще раз подтверждает важную роль кишечного микробиома в его переработке (26).Однако превращение витамина K1 в витамин K2 может не зависеть исключительно от микробиоты, как это происходит у гнотобиотических крыс (27).
Более того, животная модель с первичным дефицитом витамина К не была успешно создана с использованием только витамин К-дефицитной диеты, если в процессе не использовались стерильные мыши, что еще раз подтверждает важную роль кишечного микробиома в его переработке (26).Однако превращение витамина K1 в витамин K2 может не зависеть исключительно от микробиоты, как это происходит у гнотобиотических крыс (27).
Другие витамины, такие как витамин B1 (тиамин) (28) и фолиевая кислота (витамин B9) (29), также могут синтезироваться некоторыми членами микробиома, тем самым способствуя общему притоку витаминов. Витамин B12 может продуцироваться бактериями, например, Propionibacterium freudenreichii , Salmonella enterica , Listeria innocua и Lactobacillus reuteri , а также может разлагаться несколькими членами микробиома (30).Считается, что его связывание с внутренним фактором эукариот в процессе пищеварения защищает его от микробной деградации в дистальном отделе тонкой кишки (30).
Модуляция микробиома метаболитов, полученных из пищевых продуктов.
Множественные биоактивные небольшие молекулы желудочно-кишечного тракта происходят из пищевых источников, претерпевают микробные модификации и, как недавно было показано, обладают важными иммунными функциями. Одним из примеров является иммуномодулирующая аминокислота триптофан (Trp), которая в большом количестве содержится в таких продуктах, как молоко, яйца, красное мясо и овощи (например,г., брокколи). Известно, что Trp подвергается метаболизму с помощью Lactobacilli , что приводит к образованию индол-3-альдегида, который может связываться с арилуглеводородным рецептором (AHR), с последующим его переносом через слой эпителиальных клеток транспортером, содержащим фермент, превращающий ангиотензин I. (9, 31). Дефицит мышиного фермента 2, превращающего ангиотензин I, который контролирует уровни нейтральных аминокислот в кишечнике, включая Trp, приводит к более высокой восприимчивости к воспалению кишечника и изменению микробного состава кишечника (32). Воспаление в этом контексте передается через передачу микробиоты мышам, свободным от микробов, тогда как диетическое восполнение Trp спасает микробный дисбиоз (32).
Воспаление в этом контексте передается через передачу микробиоты мышам, свободным от микробов, тогда как диетическое восполнение Trp спасает микробный дисбиоз (32).
Микробиомная модуляция метаболитов, происходящих от хозяина.
Микробиом может также модулировать метаболиты, вырабатываемые эукариотическим хозяином. Важным примером таких эндогенно генерируемых метаболитов желудочно-кишечного тракта являются желчные кислоты, которые вырабатываются печенью из холестерина, затем конъюгируются с глицином (у людей) или таурином (у мышей) и транспортируются в желчный пузырь, общий желчный проток и проксимальные малые участки. кишечник (33, 34).Они считаются необходимыми для растворения пищевых жиров и холестерина, тем самым ускоряя пищеварение и всасывание.
Вторичный микробный метаболизм от первичных до вторичных желчных кислот увеличивает их разнообразие (35), примером чему служат мыши без микробов, имеющие более низкие уровни и меньшее разнообразие вторичных желчных кислот по сравнению с колонизированными мышами (36). В кишечном эпителии множество различных желчных кислот, включая дезоксихолевую кислоту, модулированную микробиомом, и литохолевую кислоту (37), могут связывать рецептор TGR5, связанный с G-белком, а также рецептор фарнезоида X ядерного рецептора (FXR).Было высказано предположение, что FXR регулирует целостность эпителиальных клеток и состав бактерий, поскольку в отсутствие FXR у мышей нарушена функция эпителиального барьера и наблюдается дисбиоз (38). Кроме того, вторичная передача сигналов желчной кислоты может влиять на иммунный ответ хозяина, модулируя провоспалительные гены посредством передачи сигналов NF-κB (39, 40). Таким образом, добавление лиганда FXR к макрофагам, обработанным LPS, подавляло регуляцию контролируемых NF-κB генов IL-1β, TNF-α, COX-1, COX-2 и iNOS. Более того, у мышей Fxr — / — наблюдалось значительное обострение симптомов колита, которое можно было смягчить путем лечения мышей дикого типа (WT) аналогом FXR (40).Кроме того, недавно было высказано предположение, что передача сигналов желчной кислоты способствует влиянию микробиоты на метаболический синдром, что частично может быть связано с ее иммуномодулирующими эффектами (41, 42).
В кишечном эпителии множество различных желчных кислот, включая дезоксихолевую кислоту, модулированную микробиомом, и литохолевую кислоту (37), могут связывать рецептор TGR5, связанный с G-белком, а также рецептор фарнезоида X ядерного рецептора (FXR).Было высказано предположение, что FXR регулирует целостность эпителиальных клеток и состав бактерий, поскольку в отсутствие FXR у мышей нарушена функция эпителиального барьера и наблюдается дисбиоз (38). Кроме того, вторичная передача сигналов желчной кислоты может влиять на иммунный ответ хозяина, модулируя провоспалительные гены посредством передачи сигналов NF-κB (39, 40). Таким образом, добавление лиганда FXR к макрофагам, обработанным LPS, подавляло регуляцию контролируемых NF-κB генов IL-1β, TNF-α, COX-1, COX-2 и iNOS. Более того, у мышей Fxr — / — наблюдалось значительное обострение симптомов колита, которое можно было смягчить путем лечения мышей дикого типа (WT) аналогом FXR (40).Кроме того, недавно было высказано предположение, что передача сигналов желчной кислоты способствует влиянию микробиоты на метаболический синдром, что частично может быть связано с ее иммуномодулирующими эффектами (41, 42).
Одна недавно обнаруженная роль метаболитов, модулируемых микробиомом, в кишечном иммунном ответе включает передачу сигналов через инфламмасому Nlrp6 . Было высказано предположение, что связанный с желчной кислотой метаболит таурин формирует интерфейс хозяин-микробиота посредством активации передачи сигналов воспаления Nlrp6 , что приводит к секреции IL-18 эпителиальными клетками кишечника и последующей модуляции транскрипции антимикробного пептида (43), тем самым влияя на микробиом. состав и риск возникновения ауто-воспаления.Модулируемые микробиомом метаболиты гистамин и спермин, в свою очередь, ингибируют передачу сигналов инфламмасомы NLRP6, предполагая механизм, с помощью которого комбинация биоактивных метаболитов в определенных условиях управляет интерфейсом хозяин-микробиом, полностью регулируя иммунное зондирование и последующую иммунную модуляцию. В совокупности вмешательство постбиотических метаболитов может быть нацелено на различные пути, связанные с хозяином, включая те, которые приведены в примерах выше, что представляет собой многообещающий потенциальный новый терапевтический метод лечения метаболических и воспалительных нарушений, связанных с микробиомом.
Механизмы иммунной регуляции метаболитов, модулируемых микробиотой
Метаболиты, модулируемые микробиомом, могут влиять на иммунный ответ хозяина посредством нескольких механизмов, которые только начинают разгадываться. В дополнение к индуцированной метаболитами передаче сигналов в подмножествах иммунных клеток, которые могут запускать каскад воспалительных изменений, недавние исследования выявили прямые опосредованные метаболитами эффекты на метаболизм иммунных клеток, часто приводящие к существенным, ранее недооцененным функциональным результатам.
Перепрограммирование метаболизма иммунных клеток.
Одна из недавно охарактеризованных функций комменсальной микробиоты заключается в обеспечении энергией эпителиальных клеток кишечника (IEC) посредством ферментации пищевых волокон путем разложения непереваренных сложных углеводов на SCFA. В отсутствие микробиоты и связанных с ней SCFAs у беспроблемных мышей наблюдается измененный энергетический метаболизм, характеризующийся преимущественной ферментацией глюкозы в лактат (44), что приводит к усилению аутофагии IEC в результате недостатка питательных веществ (45, 46). Моноинокуляция стерильных мышей продуцентом бутирата Butyrivibrio fibrisolvens спасла IEC от аутофагии и недостаточности митохондриального дыхания (45). Подобно эпителиальным клеткам, на энергетический обмен лейкоцитов влияют метаболиты, регулируемые микробиотой. Ответы Т-клеток зависят от катаболизма питательных веществ, тогда как кишечные Т-клетки у стерильных мышей представляют незрелый фенотип, характеризующийся нарушенной цитолитической активностью (47, 48).
Моноинокуляция стерильных мышей продуцентом бутирата Butyrivibrio fibrisolvens спасла IEC от аутофагии и недостаточности митохондриального дыхания (45). Подобно эпителиальным клеткам, на энергетический обмен лейкоцитов влияют метаболиты, регулируемые микробиотой. Ответы Т-клеток зависят от катаболизма питательных веществ, тогда как кишечные Т-клетки у стерильных мышей представляют незрелый фенотип, характеризующийся нарушенной цитолитической активностью (47, 48).
Молекулярные механизмы, с помощью которых SCFAs, такие как бутират, служат источниками энергии и, как следствие, функциональными модуляторами кишечных эпителиальных клеток и иммунных клеток, начинают выясняться (45).Бутират действует как местный субстрат для производства энергии через цикл трикарбоновых кислот, генерации АТФ и β-окисления, а также посредством подавления аутофагии в эпителиальных клетках кишечника (45).
Транскрипционная и эпигенетическая модуляция иммуно-связанных генов
Другой ключевой механизм, с помощью которого модулируемые микробиомом кишечника метаболиты влияют на иммунный ответ, включает регуляцию транскрипционного программирования иммунных клеток посредством воздействия на их эпигенетический ландшафт. Один из таких примеров относится к транскрипции связанных с муцином генов бутиратом, тем самым способствуя дифференцировке бокаловидных клеток и образованию слизи (49–51), которые необходимы для врожденной иммунной защиты хозяина от вторжения патогенов. Кроме того, ингибирующая активность бутирата гистондеацетилазы (HDAC) вызывает изменения экспрессии генов в DC, включая подавление IL-12, IL-6 и Relb, что способствует дифференцировке Treg (52). Бутират также играет роль в модуляции иммунного ответа в макрофагах, подавляя транскрипцию провоспалительных медиаторов в макрофагах собственной пластинки толстой кишки, таких как Il6 , Nos2, и Il12 (53), механизм, способствующий поддержанию толерантности. по отношению к комменсальным бактериям.
Один из таких примеров относится к транскрипции связанных с муцином генов бутиратом, тем самым способствуя дифференцировке бокаловидных клеток и образованию слизи (49–51), которые необходимы для врожденной иммунной защиты хозяина от вторжения патогенов. Кроме того, ингибирующая активность бутирата гистондеацетилазы (HDAC) вызывает изменения экспрессии генов в DC, включая подавление IL-12, IL-6 и Relb, что способствует дифференцировке Treg (52). Бутират также играет роль в модуляции иммунного ответа в макрофагах, подавляя транскрипцию провоспалительных медиаторов в макрофагах собственной пластинки толстой кишки, таких как Il6 , Nos2, и Il12 (53), механизм, способствующий поддержанию толерантности. по отношению к комменсальным бактериям.
В дополнение к его возможному влиянию на клеточный метаболизм, бутират, как было показано, влияет на периферические Tregs посредством повышенного ацетилирования гистона h4 промоторной области Foxp3 и внутригенных энхансерных элементов консервативной некодирующей последовательности ДНК 1, связанной с экспрессией гена (54, 55). . Таким образом, было продемонстрировано, что бутират косвенно подавляет воспаление толстой кишки за счет опосредованной рецептором GPR109A регуляции дифференцировки Treg (56).
. Таким образом, было продемонстрировано, что бутират косвенно подавляет воспаление толстой кишки за счет опосредованной рецептором GPR109A регуляции дифференцировки Treg (56).
Эпигенетическая супрессивная активность SCFAs может быть вертикально передана потомству, поскольку кормление беременных самок мышей с высоким содержанием клетчатки подавляло экспрессию генов, связанных с реакцией дыхательных путей в легких плода (57).Точно так же SCFAs также могут влиять на функцию лейкоцитов и хемотаксис нейтрофилов (58) посредством ингибирования активности HDAC, что приводит к инактивации NF-κB и подавлению провоспалительных цитокинов и оксида азота (58, 59). Подобное подавление HDAC, приводящее к противовоспалительному фенотипу, наблюдалось в DC и кишечных макрофагах (53, 60, 61).
Помимо того, что GPR109A является рецептором бутирата, он также является рецептором никотиновой кислоты микробного происхождения (NA или ниацин).Бутират микробного происхождения и NA взаимодействуют с GPR109A на эпителиальных клетках, макрофагах и DC и запускают секрецию IL-18 из эпителиальных клеток и IL-10 из DC и макрофагов, что дополнительно приводит к подавлению воспаления, поскольку IL-10 способствует развитие Treg из наивных клеток CD4 + (56). Ацетат SCFA может также связывать GPR43 на IEC, что приводит к сборке инфламмасомы NLRP3 и последующей продукции IL-18 (62). Таким образом, ацетат способствует целостности эпителиальных клеток, что способствует защите от инфекции (63).
Ацетат SCFA может также связывать GPR43 на IEC, что приводит к сборке инфламмасомы NLRP3 и последующей продукции IL-18 (62). Таким образом, ацетат способствует целостности эпителиальных клеток, что способствует защите от инфекции (63).
Некоторые опосредованные микробиомом транскрипционные и эпигенетические модификации хозяина могут включать передачу сигналов метаболитов, однако такие метаболиты и их предполагаемая роль в этих модификациях до настоящего времени не идентифицированы. Ярким примером общегеномных эпигенетических эффектов, опосредованных микробиомом кишечника и влияющих на иммунный ответ слизистых оболочек, являются ILC (64). Недавно было показано, что транскрипционный ландшафт субпопуляций ILC включает сложную и специфичную для субпопуляций программу эпигенетической модификации.Важно отметить, что истощение микробиоты при лечении антибиотиками широкого спектра действия или у стерильных мышей приводит к массивной реструктуризации глобального эпигенетического ландшафта ИЛЦ тонкого кишечника, включая несколько тысяч модификаций гистонов на сайтах энхансеров и промоторов. Кроме того, влияние кишечной микробиоты на измененную экспрессию генов в ILC различается между отдельными, недавно обнаруженными транскрипционными подмножествами. Это говорит о том, что в популяции ILC тонкого кишечника разные кластеры клеток обладают разными паттернами реактивности микробиоты, возможно, за счет определенных наборов эпигенетических модификаций (64).Являются ли некоторые из этих опосредованных микробиомом эпигенетических изменений в ILC результатом функций метаболитов, заслуживает будущих исследований. Другой заметный транскрипционный результат колонизации микробиома, который может включать еще не идентифицированную передачу сигналов метаболита, — это опосредованная микробиомом модуляция иммунного ответа T H 17. После колонизации сегментированными нитчатыми бактериями (SFB), которые, как известно, прикрепляются к слизистой оболочке кишечника в зависимости от вида хозяина, уровни T H 17 у стерильных мышей восстанавливаются (65), что приводит к индукции транскрипции T .
Кроме того, влияние кишечной микробиоты на измененную экспрессию генов в ILC различается между отдельными, недавно обнаруженными транскрипционными подмножествами. Это говорит о том, что в популяции ILC тонкого кишечника разные кластеры клеток обладают разными паттернами реактивности микробиоты, возможно, за счет определенных наборов эпигенетических модификаций (64).Являются ли некоторые из этих опосредованных микробиомом эпигенетических изменений в ILC результатом функций метаболитов, заслуживает будущих исследований. Другой заметный транскрипционный результат колонизации микробиома, который может включать еще не идентифицированную передачу сигналов метаболита, — это опосредованная микробиомом модуляция иммунного ответа T H 17. После колонизации сегментированными нитчатыми бактериями (SFB), которые, как известно, прикрепляются к слизистой оболочке кишечника в зависимости от вида хозяина, уровни T H 17 у стерильных мышей восстанавливаются (65), что приводит к индукции транскрипции T . H 17 ассоциированных генов, включая Il17A , Il21 , Ccr6, и Nos2 , а также сывороточный амилоид А и антимикробные пептиды (65).Было показано, что SFB-индуцированные клетки T H 17 распознают SFB Ag через еще нераспознанные механизмы, тогда как DC-экспрессия MHCII необходима для индукции клеток T H 17 (66).
H 17 ассоциированных генов, включая Il17A , Il21 , Ccr6, и Nos2 , а также сывороточный амилоид А и антимикробные пептиды (65).Было показано, что SFB-индуцированные клетки T H 17 распознают SFB Ag через еще нераспознанные механизмы, тогда как DC-экспрессия MHCII необходима для индукции клеток T H 17 (66).
Иммунная модуляция метаболитов с помощью еще неизвестных механизмов.
Поскольку функции организма, опосредованные метаболитами, только начинают обнаруживаться, некоторые эффекты еще не полностью определены механически. Например, некоторые механизмы модулирующего воздействия SCFAs на иммунные функции хозяина были расшифрованы и описаны выше, но другие остаются загадочными и могут управляться внутриклеточными метаболическими путями, эпигенетической модификацией, регуляцией транскрипции или другим, еще не определенным механизмом (ами). .Различные SCFAs могут различаться через рецепторы GPR41, GPR43 и GPR109A (10). Бутират является лигандом для GPR109A, экспрессируемого IEC и Т-клетками, где его передача сигналов оказывает существенное влияние на количество и активность Treg, но механизм этого эффекта до сих пор полностью не изучен (56). Точно так же макрофаги толстой кишки и DC мышей, дефицитных по GPR109A, не обладают способностью индуцировать дифференцировку наивных Т-клеток в экспрессирующие IL-10 Treg, что приводит к общему снижению Treg в толстой кишке и увеличению тяжести колита, индуцированного декстраном сульфатом натрия. через механизмы, которые все еще неуловимы (56).У свободных от зародышей и колонизированных мышей, получавших SCFAs, такие как ацетат, наблюдалось снижение воспаления на модели колита, индуцированного декстраном сульфатом натрия, а также на модели колита с переносом Т-клеток в зависимости от GPR43. Механически введение SCFA увеличивает количество Treg-клеток у стерильных мышей, а также секрецию его ключевого супрессивного эффекторного цитокина IL-10, возможно, за счет воздействия на метаболизм иммунных клеток (54, 67).
Бутират является лигандом для GPR109A, экспрессируемого IEC и Т-клетками, где его передача сигналов оказывает существенное влияние на количество и активность Treg, но механизм этого эффекта до сих пор полностью не изучен (56). Точно так же макрофаги толстой кишки и DC мышей, дефицитных по GPR109A, не обладают способностью индуцировать дифференцировку наивных Т-клеток в экспрессирующие IL-10 Treg, что приводит к общему снижению Treg в толстой кишке и увеличению тяжести колита, индуцированного декстраном сульфатом натрия. через механизмы, которые все еще неуловимы (56).У свободных от зародышей и колонизированных мышей, получавших SCFAs, такие как ацетат, наблюдалось снижение воспаления на модели колита, индуцированного декстраном сульфатом натрия, а также на модели колита с переносом Т-клеток в зависимости от GPR43. Механически введение SCFA увеличивает количество Treg-клеток у стерильных мышей, а также секрецию его ключевого супрессивного эффекторного цитокина IL-10, возможно, за счет воздействия на метаболизм иммунных клеток (54, 67). Более того, отсутствие экспрессии GPR43 у мышей Gpr43 — / — серьезно изменяет SCFA-опосредованную экспансию Tregs толстой кишки (54).Таким образом, SCFAs и их GPR представляют собой один из путей, посредством которых комменсальная микробиота регулирует воспалительный ответ, однако внутриклеточные и иммуноопосредованные механизмы эффектов этих метаболитов заслуживают дальнейших исследований. Подобно их локальному действию в кишечнике, циркулирующие SCFAs уменьшают тяжесть аллергического воспаления дыхательных путей за счет снижения уровней IL-4, IL-5, IL-13 и IL-17a в легких, возможно, за счет увеличения образования макрофагов в костном мозге. и DC; этот и другие потенциальные механизмы заслуживают дальнейшего изучения (60).
Более того, отсутствие экспрессии GPR43 у мышей Gpr43 — / — серьезно изменяет SCFA-опосредованную экспансию Tregs толстой кишки (54).Таким образом, SCFAs и их GPR представляют собой один из путей, посредством которых комменсальная микробиота регулирует воспалительный ответ, однако внутриклеточные и иммуноопосредованные механизмы эффектов этих метаболитов заслуживают дальнейших исследований. Подобно их локальному действию в кишечнике, циркулирующие SCFAs уменьшают тяжесть аллергического воспаления дыхательных путей за счет снижения уровней IL-4, IL-5, IL-13 и IL-17a в легких, возможно, за счет увеличения образования макрофагов в костном мозге. и DC; этот и другие потенциальные механизмы заслуживают дальнейшего изучения (60).
Метаболиты, модулируемые микробиомом, и риск заболевания
Определенные композиционные и функциональные изменения микробиома были связаны с патогенезом распространенных многофакторных заболеваний. Эти заболевания включают, среди прочего, патологии, поражающие в первую очередь пищеварительную систему [такие как воспалительные заболевания кишечника (ВЗК) и колоректальный рак], метаболические заболевания (сахарный диабет и неалкогольная жировая болезнь печени) и даже сердечно-сосудистые и неврологические нарушения (68–73) . Таким образом, разумно предположить, что, по крайней мере, некоторые из эффектов микробиома могут быть опосредованы измененными профилями метаболитов, связанными с этими признаками микробных заболеваний. Такие измененные уровни метаболитов и их комбинации могут влиять на иммунную функцию и метаболизм, а также на множество других, казалось бы, не связанных физиологических функций. Хотя сложная сеть взаимодействий между микробиомом, связанным с ним профилем метаболитов и иммунной системой в контексте заболевания только начинает раскрываться, несколько исследований, приведенных ниже, выявили некоторые пути, лежащие в основе этих взаимодействий (рис.3).
Таким образом, разумно предположить, что, по крайней мере, некоторые из эффектов микробиома могут быть опосредованы измененными профилями метаболитов, связанными с этими признаками микробных заболеваний. Такие измененные уровни метаболитов и их комбинации могут влиять на иммунную функцию и метаболизм, а также на множество других, казалось бы, не связанных физиологических функций. Хотя сложная сеть взаимодействий между микробиомом, связанным с ним профилем метаболитов и иммунной системой в контексте заболевания только начинает раскрываться, несколько исследований, приведенных ниже, выявили некоторые пути, лежащие в основе этих взаимодействий (рис.3).
Метаболиты и болезни, модулируемые микробиомом. Измененные уровни метаболитов, модулируемых микробиомом, связаны с иммуно-опосредованным и иммуно-ассоциированным риском заболеваний. Метаболиты-опосредованные эффекты на болезненные процессы могут быть локализованы в желудочно-кишечном тракте, например, при ВЗК или пищевой аллергии, или системно влиять на удаленные ткани, такие как мозг, сердце и печень.
Воспалительное заболевание кишечника.
Заболеваемость ВЗК, группой аутовоспалительных заболеваний, поражающих различные области желудочно-кишечного тракта, неуклонно растет во всем мире (70).Одним из характерных признаков ВЗК является дисбактериоз кишечника — отклонение от здорового состава и функции микробиома. Дисбиоз может способствовать нарушению перекрестной связи между иммунными клетками и микробиомом при ВЗК и может включать аберрантную передачу сигналов от различных иммуномодулирующих метаболитов. Например, в животной модели язвенного колита взаимодействие между комменсальной микробиотой и ILC группы 3, экспрессирующей AHR, опосредуется метаболитами, продуцируемыми микробиотой (31, 74).Отсутствие AHR или его лигандов вызывает изменения в микробном составе, что приводит к обострению развития колита у мышей (75). Подмножество комменсальных бактерий использует Trp в качестве источника энергии и продуцирует метаболит индол-3-альдегид, который дополнительно активирует AHR в ILC, что приводит к секреции IL-22, влияя как на заживление слизистой оболочки, так и на репертуар антимикробных пептидов, включая липокалин-2.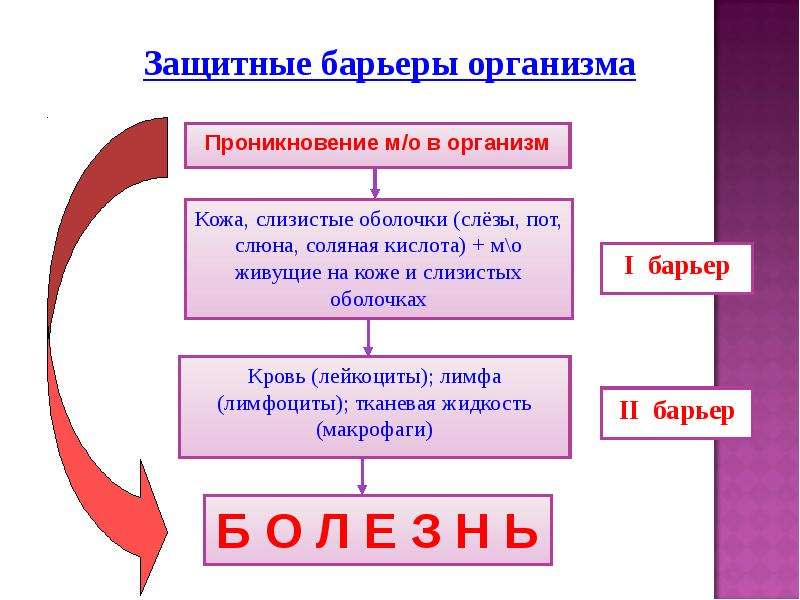 , S100A8 и S100A9 у мышей (31, 74). Другой возможный механизм ауто-воспаления, опосредованный метаболитами, включает SCFA-опосредованное ингибирование HDAC, независимо от их рецепторов GPR41 и GPR43, что приводит к активации Т-клетками пути mTOR-S6K (76).Добавление ацетата в питьевую воду способствовало снижению тяжести индуцированного анти-CD3 колита в подвздошной кишке мышей дикого типа, но не у мышей Il10 — / — , что указывает на то, что этот защитный эффект требует наличия IL-10 (76). Напротив, пероральное лечение бутиратом увеличивало уровни ИЛ-23 в ДК и обостряло симптомы колита на животной модели ВЗК (77). Поскольку эффекты SCFA являются сложными, а иногда и разнообразными, косвенными и комбинаторными, будущие исследования должны будут определить их значение для человека и терапевтический потенциал в различных комбинациях и клинических контекстах.
, S100A8 и S100A9 у мышей (31, 74). Другой возможный механизм ауто-воспаления, опосредованный метаболитами, включает SCFA-опосредованное ингибирование HDAC, независимо от их рецепторов GPR41 и GPR43, что приводит к активации Т-клетками пути mTOR-S6K (76).Добавление ацетата в питьевую воду способствовало снижению тяжести индуцированного анти-CD3 колита в подвздошной кишке мышей дикого типа, но не у мышей Il10 — / — , что указывает на то, что этот защитный эффект требует наличия IL-10 (76). Напротив, пероральное лечение бутиратом увеличивало уровни ИЛ-23 в ДК и обостряло симптомы колита на животной модели ВЗК (77). Поскольку эффекты SCFA являются сложными, а иногда и разнообразными, косвенными и комбинаторными, будущие исследования должны будут определить их значение для человека и терапевтический потенциал в различных комбинациях и клинических контекстах.
Другой пример роли оси микробиом-иммунный метаболит в управлении кишечным аутовоспалением представлен на модели инфламмасомы NLRP6 у мышей. Как описано выше, правильно функционирующая передача сигналов инфламмасомы NLRP6, организованная с помощью модулированных микробиомом метаболитов таурина, гистамина и спермина (43) в IEC мышей, способствует здоровой популяции микробиома. Напротив, у мышей с дефицитом NLRP6 наблюдается дисбактериоз и ассоциированное кишечное аутовоспаление, которое передается через фекальную трансплантацию нормальным мышам WT, тем самым вызывая обострение симптомов колита, которые улучшаются за счет восстановления нормальной микробиоты (43).Множество других неизвестных метаболитов у мышей и пациентов с ВЗК могут влиять на активацию и функцию иммунной системы, тем самым влияя на патогенез различных подгрупп ВЗК, и заслуживают дальнейших исследований.
Как описано выше, правильно функционирующая передача сигналов инфламмасомы NLRP6, организованная с помощью модулированных микробиомом метаболитов таурина, гистамина и спермина (43) в IEC мышей, способствует здоровой популяции микробиома. Напротив, у мышей с дефицитом NLRP6 наблюдается дисбактериоз и ассоциированное кишечное аутовоспаление, которое передается через фекальную трансплантацию нормальным мышам WT, тем самым вызывая обострение симптомов колита, которые улучшаются за счет восстановления нормальной микробиоты (43).Множество других неизвестных метаболитов у мышей и пациентов с ВЗК могут влиять на активацию и функцию иммунной системы, тем самым влияя на патогенез различных подгрупп ВЗК, и заслуживают дальнейших исследований.
Неалкогольная жировая болезнь печени.
Неалкогольная жировая болезнь печени (НАЖБП) является наиболее распространенным заболеванием печени в развитых странах и тесно связана с другими особенностями метаболического синдрома, включая ожирение, гиперлипидемию и сахарный диабет у взрослых. В то время как у большинства пораженных пациентов симптомы отсутствуют, у значительного меньшинства случаев НАЖБП развивается прогрессирующее воспалительное заболевание печени, называемое неалкогольным стеатогепатитом (НАСГ), что в конечном итоге приводит к дисфункции печени, циррозу и опасным для жизни осложнениям (78).Микробиом был предложен как на моделях мышей, так и на людях, чтобы регулировать некоторые проявления НАЖБП и НАСГ через его системные эффекты на иммунную систему (79, 80). В одной из таких моделей на животных у мышей с дефицитом инфламмасом наблюдается дисбактериоз, опосредованный измененным профилем метаболитов (81). При индуцировании НАЖБП у этих мышей развивалась контекстно-зависимая форма дисбиоза, характеризующаяся массивной экспансией Porphyromonadaceae , сопровождаемой усиленным притоком лигандов TLR4 и TLR9 в портальный кровоток и приводящим к массивной секреции TNF-α, воспалению печени и прогрессирование до НАСГ (82).Интересно, что этот опосредованный микробиомом переход в НАСГ был отменен лечением антибиотиками широкого спектра действия и перенесен путем совместного проживания мышей с дефицитом инфламмасомы с мышами WT.
В то время как у большинства пораженных пациентов симптомы отсутствуют, у значительного меньшинства случаев НАЖБП развивается прогрессирующее воспалительное заболевание печени, называемое неалкогольным стеатогепатитом (НАСГ), что в конечном итоге приводит к дисфункции печени, циррозу и опасным для жизни осложнениям (78).Микробиом был предложен как на моделях мышей, так и на людях, чтобы регулировать некоторые проявления НАЖБП и НАСГ через его системные эффекты на иммунную систему (79, 80). В одной из таких моделей на животных у мышей с дефицитом инфламмасом наблюдается дисбактериоз, опосредованный измененным профилем метаболитов (81). При индуцировании НАЖБП у этих мышей развивалась контекстно-зависимая форма дисбиоза, характеризующаяся массивной экспансией Porphyromonadaceae , сопровождаемой усиленным притоком лигандов TLR4 и TLR9 в портальный кровоток и приводящим к массивной секреции TNF-α, воспалению печени и прогрессирование до НАСГ (82).Интересно, что этот опосредованный микробиомом переход в НАСГ был отменен лечением антибиотиками широкого спектра действия и перенесен путем совместного проживания мышей с дефицитом инфламмасомы с мышами WT.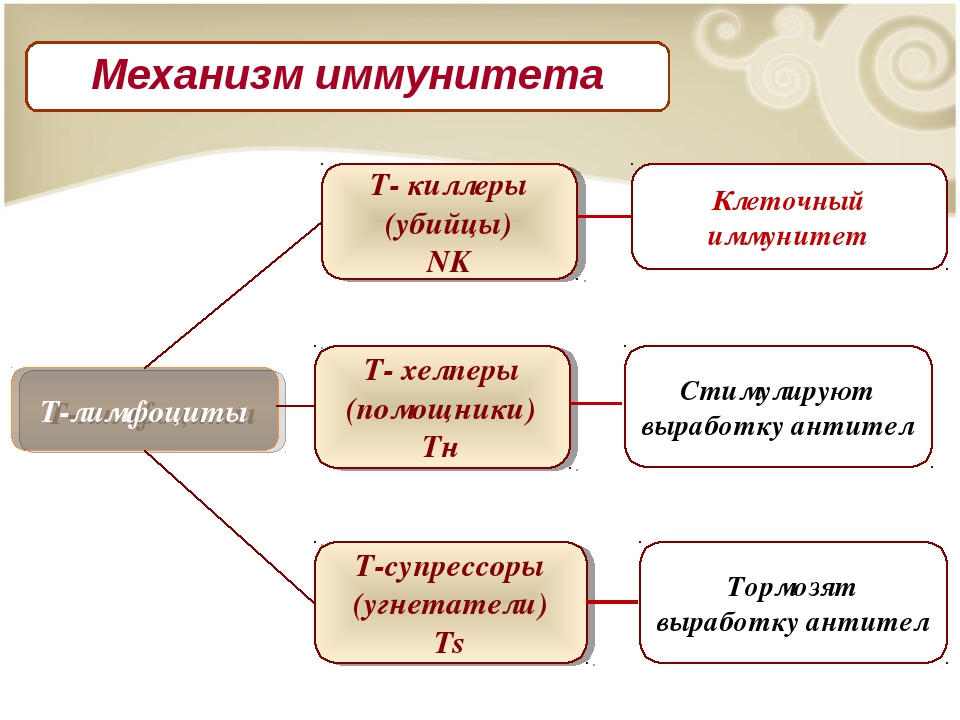 Поскольку дисбактериоз в этой модели недавно был связан с дисбалансом метаболитов, модулированным микробиомом, это указывает на возможность существования косвенной связи между изменениями метаболитов в желудочно-кишечном тракте, дисбиозом и притоком микробных продуктов в печень, приводящим к воспалительным последствиям (43).Аналогичным образом, у людей с НАЖБП дисбактериоз наблюдался с увеличением родов Streptococcus , Anaerobacter , Lactobacillus и Escherichia по сравнению со здоровыми субъектами, что сопровождалось уменьшением на Alistipes и Prevotella . Подобно описанной выше модели на животных, у пациентов с НАЖБП были обнаружены более высокие уровни TNF-α, IFN-γ и IL-6, а также нарушенная морфология микроворсинок, связанная с повышенной проницаемостью кишечника (83).Эти результаты предполагают, что дисбактериоз может не только влиять на местную воспалительную реакцию кишечника, но также может системно влиять на стерильные ткани через метаболиты, вызывающие патологические состояния, как воспалительные, так и метаболические.
Поскольку дисбактериоз в этой модели недавно был связан с дисбалансом метаболитов, модулированным микробиомом, это указывает на возможность существования косвенной связи между изменениями метаболитов в желудочно-кишечном тракте, дисбиозом и притоком микробных продуктов в печень, приводящим к воспалительным последствиям (43).Аналогичным образом, у людей с НАЖБП дисбактериоз наблюдался с увеличением родов Streptococcus , Anaerobacter , Lactobacillus и Escherichia по сравнению со здоровыми субъектами, что сопровождалось уменьшением на Alistipes и Prevotella . Подобно описанной выше модели на животных, у пациентов с НАЖБП были обнаружены более высокие уровни TNF-α, IFN-γ и IL-6, а также нарушенная морфология микроворсинок, связанная с повышенной проницаемостью кишечника (83).Эти результаты предполагают, что дисбактериоз может не только влиять на местную воспалительную реакцию кишечника, но также может системно влиять на стерильные ткани через метаболиты, вызывающие патологические состояния, как воспалительные, так и метаболические. Недавно было высказано предположение, что другие проявления метаболического синдрома, такие как ожирение и непереносимость глюкозы, связаны с измененной воспалительной реакцией в таких тканях, как жировая ткань, поджелудочная железа и печень (84). Интересная, но неисследованная возможность заключается в том, что некоторые из этих воспалительных изменений могут быть опосредованы дисбактериозом и связанным с ним изменением конфигурации метаболитов.Изучение ролей метаболитов в этих контекстах может позволить идентифицировать новые терапевтические и диагностические методы лечения этих распространенных идиопатических многофакторных расстройств.
Недавно было высказано предположение, что другие проявления метаболического синдрома, такие как ожирение и непереносимость глюкозы, связаны с измененной воспалительной реакцией в таких тканях, как жировая ткань, поджелудочная железа и печень (84). Интересная, но неисследованная возможность заключается в том, что некоторые из этих воспалительных изменений могут быть опосредованы дисбактериозом и связанным с ним изменением конфигурации метаболитов.Изучение ролей метаболитов в этих контекстах может позволить идентифицировать новые терапевтические и диагностические методы лечения этих распространенных идиопатических многофакторных расстройств.
Сердечно-сосудистые заболевания.
Катастрофические последствия атеросклероза, инфаркта миокарда и нарушения мозгового кровообращения по-прежнему являются причиной большинства смертей во всем мире (85). Атеросклеротические бляшки в стенках артерий вызваны несбалансированным гомеостазом липидов, приводящим к накоплению холестерин-содержащих частиц липопротеинов низкой плотности, сопровождающемуся хроническим воспалением (86). В последнее десятилетие изменения в составе и функциях микробиома были связаны с патогенезом сердечно-сосудистых заболеваний. Один из ярких примеров такой ассоциации включает метаболизм триметиламин-N-оксида (ТМАО). ТМАО — это метаболит, который у человека образуется в результате микробного метаболизма диетического фосфатидилхолина или l-карнитина, которых много в мясных и жирных диетах. Мыши, получавшие l-карнитин, показали повышенный уровень ТМАО, что привело к усилению атеросклероза. Свободные от микробов мыши или мыши, получавшие лечение антибиотиками, были защищены от болезни, тем самым связывая микробиоту кишечника, питание и риск сердечно-сосудистых заболеваний (87).Подобные результаты наблюдались у людей, у которых было зарегистрировано зависящее от времени увеличение ТМАО в плазме (и других метаболитов фосфатидилхолина) после приема пищи, меченной изотопами. Эти повышенные уровни метаболитов подавлялись лечением антибиотиками и снова появлялись после отмены антибиотиков (88). Повышенные уровни ТМАО в плазме натощак были в значительной степени связаны с серьезными сердечно-сосудистыми событиями, такими как общая смертность, инфаркт миокарда или инсульт.
В последнее десятилетие изменения в составе и функциях микробиома были связаны с патогенезом сердечно-сосудистых заболеваний. Один из ярких примеров такой ассоциации включает метаболизм триметиламин-N-оксида (ТМАО). ТМАО — это метаболит, который у человека образуется в результате микробного метаболизма диетического фосфатидилхолина или l-карнитина, которых много в мясных и жирных диетах. Мыши, получавшие l-карнитин, показали повышенный уровень ТМАО, что привело к усилению атеросклероза. Свободные от микробов мыши или мыши, получавшие лечение антибиотиками, были защищены от болезни, тем самым связывая микробиоту кишечника, питание и риск сердечно-сосудистых заболеваний (87).Подобные результаты наблюдались у людей, у которых было зарегистрировано зависящее от времени увеличение ТМАО в плазме (и других метаболитов фосфатидилхолина) после приема пищи, меченной изотопами. Эти повышенные уровни метаболитов подавлялись лечением антибиотиками и снова появлялись после отмены антибиотиков (88). Повышенные уровни ТМАО в плазме натощак были в значительной степени связаны с серьезными сердечно-сосудистыми событиями, такими как общая смертность, инфаркт миокарда или инсульт. Эти результаты демонстрируют потенциальную центральную роль этого метаболита, полученного из микробиома, в факторе риска сердечно-сосудистых заболеваний (88, 89).
Эти результаты демонстрируют потенциальную центральную роль этого метаболита, полученного из микробиома, в факторе риска сердечно-сосудистых заболеваний (88, 89).
Пищевая аллергия.
Аллергия на компоненты питания представляет собой распространенное иммуноопосредованное состояние, одинаково затрагивающее как детское, так и взрослое население. ДК слизистой оболочки способствуют возникновению аллергии на пищевые агенты за счет регуляции дифференцировки Treg. Недавно было показано, что диета с высоким содержанием клетчатки вместе с витамином А приводит микробиоту к конфигурации, которая поддерживает толерогенные DC CD103 + , что обеспечивает толерантность к пищевым Ag на модели мышей, тем самым защищая от пищевой аллергии.Этот защитный эффект зависит от эпителиального GPR43 и иммунного GPR109A, поскольку защитный эффект не наблюдался у мышей Gpr43 — / — или Gpr109a — / — мышей. В этой модели изменения в микробиоте после диеты с высоким содержанием клетчатки также были связаны с повышенным продуцированием IgA и реакцией Т-фолликула-помощника (90), что дополнительно указывает на участие микробиома в этом защитном эффекте от пищевой аллергии.
Нейродегенеративные заболевания.
Хотя неврологические расстройства все чаще предполагают наличие важных иммунных компонентов, исследования неврологической иммуномодуляции все еще находятся в зачаточном состоянии.Некоторые из наблюдаемых иммуномодулирующих эффектов на ЦНС опосредуются резидентными подмножествами иммунных клеток в ЦНС, которые влияют на прогрессирование заболевания, и особенно микроглией, резидентными миелоидными клетками ЦНС. Интересно, что недавно было высказано предположение, что на микроглию влияют метаболиты, такие как SCFAs, на мышиной модели. SCFAs, секретируемые микробиотой кишечника, модулируют профиль экспрессии гена активации и созревания микроглии в стационарном состоянии мыши (91). Недавно было обнаружено, что рецептор NA GPR109A экспрессируется микроглией (92) и характеризуется повышенной экспрессией, колокализирующейся с микроглиальными маркерами в черной субстанции пациентов с болезнью Паркинсона, что, возможно, участвует в модуляции болезни (92). Аналогичным образом, лечение β-гидроксибутиратом на модели крыс с болезнью Паркинсона улучшало двигательные навыки и защищало нейроны нигро-полосатого тела за счет уменьшения нейровоспаления (92). Добавление β-гидроксибутирата к культурам мезэнцефальных нейронов и глии снижает вредные эффекты LPS-индуцированной активации микроглии за счет ингибирования GPR109A пути NF-κB, что приводит к снижению провоспалительных ферментов (COX-2, iNOS) и цитокинов (IL-6). , TNF-α, IL-1β) (93). Бутират и другие SCFAs поступают из желудочно-кишечного тракта через портальный кровоток или абсорбируются непосредственно в системный кровоток через дистальный отдел кровоснабжения толстой кишки и могут попадать в ЦНС через гематоэнцефалический барьер (ГЭБ).Мыши, получавшие диету с ферментированными волокнами, демонстрировали снижение болезненного поведения, связанного с эндотоксинами (94), и, что интересно, характеризовались повышенными уровнями мРНК IL-4 в ЦНС, вероятно, опосредованными усилением ацетилирования гистонов, повышающим уровни IL-1RA, что ингибирует продукцию IL-4.
Аналогичным образом, лечение β-гидроксибутиратом на модели крыс с болезнью Паркинсона улучшало двигательные навыки и защищало нейроны нигро-полосатого тела за счет уменьшения нейровоспаления (92). Добавление β-гидроксибутирата к культурам мезэнцефальных нейронов и глии снижает вредные эффекты LPS-индуцированной активации микроглии за счет ингибирования GPR109A пути NF-κB, что приводит к снижению провоспалительных ферментов (COX-2, iNOS) и цитокинов (IL-6). , TNF-α, IL-1β) (93). Бутират и другие SCFAs поступают из желудочно-кишечного тракта через портальный кровоток или абсорбируются непосредственно в системный кровоток через дистальный отдел кровоснабжения толстой кишки и могут попадать в ЦНС через гематоэнцефалический барьер (ГЭБ).Мыши, получавшие диету с ферментированными волокнами, демонстрировали снижение болезненного поведения, связанного с эндотоксинами (94), и, что интересно, характеризовались повышенными уровнями мРНК IL-4 в ЦНС, вероятно, опосредованными усилением ацетилирования гистонов, повышающим уровни IL-1RA, что ингибирует продукцию IL-4.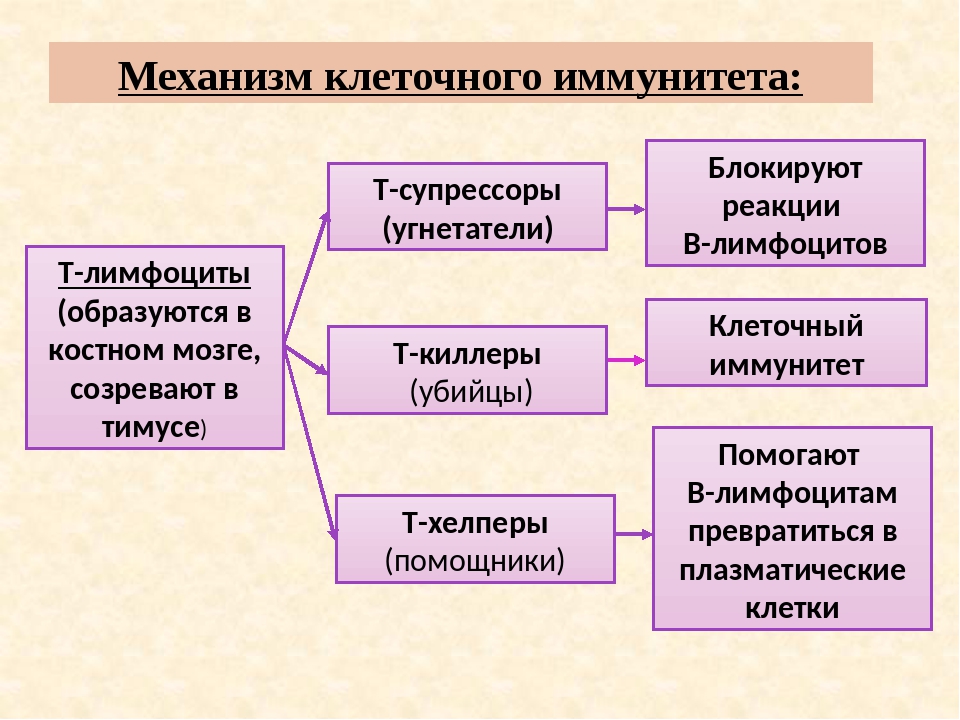 1β провоспалительный цитокин (94). Кроме того, белки, образующие плотные контакты, окклюдин и клаудин-5, были уменьшены в мозге мышей, свободных от микробов, что привело к увеличению проницаемости их ГЭБ (95). Обработка бактериями Clostridium tyrobutyricum , продуцирующими бутират, Clostridium tyrobutyricum была способна повысить уровни окклюдина и клаудина-5 в мозге стерильных мышей и восстановить их проницаемость по ГЭБ до уровня мышей, свободных от конкретных патогенов (95).
1β провоспалительный цитокин (94). Кроме того, белки, образующие плотные контакты, окклюдин и клаудин-5, были уменьшены в мозге мышей, свободных от микробов, что привело к увеличению проницаемости их ГЭБ (95). Обработка бактериями Clostridium tyrobutyricum , продуцирующими бутират, Clostridium tyrobutyricum была способна повысить уровни окклюдина и клаудина-5 в мозге стерильных мышей и восстановить их проницаемость по ГЭБ до уровня мышей, свободных от конкретных патогенов (95).
Интересно, что другие психоневрологические расстройства, такие как расстройство аутистического спектра (РАС), также предполагали, что они связаны с модуляцией зависимых от микробиоты метаболитов (72). У мышей с РАС наблюдается дисбактериоз, повышенная проницаемость кишечника и измененные метаболиты сыворотки (96). Лечение Bacteroides fragilis восстановило патологию проницаемости кишечника и неврологические симптомы РАС, вероятно, за счет регуляции 4-этилфенилсульфата, метаболита, способствующего возникновению некоторых симптомов, подобных РАС. Эти результаты предполагают, что микробиом кишечника может влиять на некоторые неврологические функции ЦНС, включая нейровоспаление, посредством регуляции системных метаболитов (96).Могут ли некоторые из этих эффектов включать измененную активацию иммунного ответа ЦНС, и могут ли подобные эффекты наблюдаться у людей, остается неясным.
Эти результаты предполагают, что микробиом кишечника может влиять на некоторые неврологические функции ЦНС, включая нейровоспаление, посредством регуляции системных метаболитов (96).Могут ли некоторые из этих эффектов включать измененную активацию иммунного ответа ЦНС, и могут ли подобные эффекты наблюдаться у людей, остается неясным.
Выводы
В этом обзоре мы выделяем некоторые примеры, с помощью которых пищевые, производные от хозяина и микробиоты метаболиты могут влиять на многие аспекты иммунного ответа хозяина. Во многих из этих наблюдений механизмы, с помощью которых комменсальные бактерии регулируют иммунитет хозяина, остаются неясными и заслуживают дальнейшего изучения.Аналогичным образом, необходимы дальнейшие исследования для определения репертуара, биогеографического распределения и биологической активности метаболитов в желудочно-кишечном тракте, а также того, как они могут влиять на местные и системные воспалительные процессы. Интеграция накопленных знаний о структуре микробного сообщества при различных сценариях заболевания с соответствующими изменениями в метаболоме и его биоактивности может позволить ответить на фундаментальные вопросы, касающиеся молекулярных механизмов, с помощью которых микробиом влияет на физиологию, патофизиологию и даже на свою собственную функцию сообщества (97). Такие исследования, вероятно, будут включать в себя интеграцию передовой геномики, связанной с секвенированием следующего поколения, высокопроизводительной метаболомики и экспериментов с гнотобиотами, которые имеют решающее значение для демонстрации причинно-следственной связи и дифференциации между основным микробным воздействием на патогенез заболевания и вторичными микробными изменениями пассажиров. Такие интегративные исследования могут потенциально дать новые методы диагностики и лечения распространенных заболеваний на основе микробиоты. Таким образом, заселение стерильных животных микробиотой людей (несмотря на присущие ей технические ограничения) недавно стало многообещающим способом упростить изучение этих сложных заболеваний (98).Гуманизированные животные, свободные от микробов, могут позволить лучше в долгосрочной перспективе выяснить роль конкретных видов бактерий, обитающих у человека, и связанных с ними метаболитов, в содействии развитию и прогрессированию болезни.
Такие исследования, вероятно, будут включать в себя интеграцию передовой геномики, связанной с секвенированием следующего поколения, высокопроизводительной метаболомики и экспериментов с гнотобиотами, которые имеют решающее значение для демонстрации причинно-следственной связи и дифференциации между основным микробным воздействием на патогенез заболевания и вторичными микробными изменениями пассажиров. Такие интегративные исследования могут потенциально дать новые методы диагностики и лечения распространенных заболеваний на основе микробиоты. Таким образом, заселение стерильных животных микробиотой людей (несмотря на присущие ей технические ограничения) недавно стало многообещающим способом упростить изучение этих сложных заболеваний (98).Гуманизированные животные, свободные от микробов, могут позволить лучше в долгосрочной перспективе выяснить роль конкретных видов бактерий, обитающих у человека, и связанных с ними метаболитов, в содействии развитию и прогрессированию болезни.
Более того, подробная и всесторонняя характеристика микробиома с использованием комбинации анализа 16S рДНК, дробного метагеномного секвенирования метагенома микробиома и метатранскриптома, в сочетании с метаболомикой и характеристикой транскриптома хозяина, может быть интегрирована в прогностическое вычислительное моделирование, которое может облегчить раннее диагностика, стратификация пациентов и индивидуальные подходы к лечению (99). Наконец, более глубокое понимание влияния различных метаболитов на гомеостаз и заболевание может проложить путь для их будущего применения в качестве средства постбиотического вмешательства, которое может позволить введение комбинаций метаболитов в качестве профилактической или терапевтической меры при заболеваниях, связанных с микробиомом, тем самым избегая необходимость иметь дело со значительной вариабельностью индивидуальных конфигураций микробиома человека.
Наконец, более глубокое понимание влияния различных метаболитов на гомеостаз и заболевание может проложить путь для их будущего применения в качестве средства постбиотического вмешательства, которое может позволить введение комбинаций метаболитов в качестве профилактической или терапевтической меры при заболеваниях, связанных с микробиомом, тем самым избегая необходимость иметь дело со значительной вариабельностью индивидуальных конфигураций микробиома человека.
Может ли подавить иммунитет блуждающего нерва?
Шесть раз в день Катрин делает паузу, вынимает из кармана небольшой магнит и прикасается им к приподнятому участку кожи чуть ниже ключицы.В течение 60 секунд она чувствует мягкую вибрацию в горле. Ее голос дрогнет, если она заговорит. Затем ощущение утихает.
Магнит включает имплантированное устройство, которое излучает серию электрических импульсов — каждый около миллиампера, подобных току, потребляемому обычным слуховым аппаратом. Эти импульсы стимулируют ее блуждающий нерв, тракт волокон, который проходит по шее от ствола мозга к нескольким основным органам, включая сердце и кишечник.
Техника, называемая стимуляцией блуждающего нерва, используется с 1990-х годов для лечения эпилепсии и с начала 2000-х годов для лечения депрессии.Но Катрин, 70-летний инструктор по фитнесу из Амстердама, попросившая изменить ее имя для этой истории, использует его для борьбы с ревматоидным артритом, аутоиммунным заболеванием, которое приводит к разрушению хрящей вокруг суставов и других тканей. Клиническое испытание, в котором она участвовала пять лет назад, является первым в своем роде на людях и представляет собой кульминацию двух десятилетий исследований связи между нервной и иммунной системами.
Для Кевина Трейси, нейрохирурга из Института медицинских исследований Файнштейна в Манхассете, штат Нью-Йорк, блуждающий нерв является основным компонентом этой связи, и он говорит, что электрическая стимуляция может представлять собой лучший способ лечения аутоиммунных заболеваний, таких как волчанка. , Болезнь Крона и др.
Несколько фармацевтических компаний вкладывают средства в «электрокцевтики» — устройства, которые могут воздействовать на нервную систему, — для лечения сердечно-сосудистых и метаболических заболеваний. Но цель Трейси по контролю воспаления с помощью такого устройства, если она удастся, станет большим шагом вперед.
Но цель Трейси по контролю воспаления с помощью такого устройства, если она удастся, станет большим шагом вперед.
Он является пионером, который «привлек на борт множество людей и проводит исследования в этой области», — говорит Дайан Лортон, нейробиолог из Кентского государственного университета в Огайо, которая провела 30 лет, изучая нервы, которые проникают в иммунные органы, такие как лимфатические узлы. и селезенка.Но она и другие наблюдатели предупреждают, что нейронные цепи, лежащие в основе противовоспалительных эффектов, еще недостаточно изучены.
Трейси признает эту критику, но все же видит огромный потенциал в электростимуляции. «В течение нашей жизни мы увидим, как устройства заменят некоторые лекарства», — говорит он. Он утверждает, что нанесение разрядов блуждающих нервов или других периферических нервов может обеспечить лечение множества заболеваний, от диабета до высокого кровяного давления и кровотечений. «Это начало области.”
Величина удара
Только случайно Трейси впервые пошла по пути нейроиммунитета. В 1998 году он изучал экспериментальный препарат CNI-1493, который подавлял воспаление у животных за счет снижения уровня мощного иммунного белка, называемого фактором некроза опухоли-α (TNF-α). CNI-1493 обычно вводили через кровоток, но однажды Трейси решила ввести его в мозг крысы. Он хотел посмотреть, снизит ли это TNF-α в мозге во время инсульта.Но то, что произошло, его удивило.
В 1998 году он изучал экспериментальный препарат CNI-1493, который подавлял воспаление у животных за счет снижения уровня мощного иммунного белка, называемого фактором некроза опухоли-α (TNF-α). CNI-1493 обычно вводили через кровоток, но однажды Трейси решила ввести его в мозг крысы. Он хотел посмотреть, снизит ли это TNF-α в мозге во время инсульта.Но то, что произошло, его удивило.
CNI-1493 в головном мозге снижает выработку TNF-α по всему телу животного. Другие эксперименты показали, что это происходит примерно в 100 000 раз эффективнее, чем при введении прямо в кровоток1. Трейси предположила, что препарат действует на нервные сигналы.
Его последующие эксперименты подтвердили эту идею. Через несколько минут после того, как он ввел CNI-1493 в мозг, Трейси увидела всплеск активности, пробегающий по блуждающему нерву крысы2. Эта нейронная магистраль регулирует несколько непроизвольных функций, включая частоту сердечных сокращений, дыхание и мышечные сокращения, которые проталкивают пищу через кишечник. Трейси предположила, что он также может контролировать воспаление. Когда он перерезал нерв и мощное действие препарата исчезло, он был убежден. «Это изменило правила игры», — говорит Трейси. Открытие означало, что если бы можно было стимулировать блуждающий нерв, в этом лекарстве даже не было бы необходимости.
Трейси предположила, что он также может контролировать воспаление. Когда он перерезал нерв и мощное действие препарата исчезло, он был убежден. «Это изменило правила игры», — говорит Трейси. Открытие означало, что если бы можно было стимулировать блуждающий нерв, в этом лекарстве даже не было бы необходимости.
Итак, он провел ключевой эксперимент. Он ввел крысе смертельную дозу эндотоксина, компонента клеточной стенки бактерий, который отправляет животных в спираль воспаления, органной недостаточности и смерти. Действие препарата примерно соответствует септическому шоку у человека.Затем Трейси стимулировала блуждающий нерв животного с помощью электрода. У обработанных крыс в кровотоке было всего на четверть меньше TNF-α, чем у необработанных животных, и они не впали в шок3.
Трейси мгновенно увидела медицинский потенциал стимуляции блуждающего нерва как способа блокировать выбросы TNF-α и других воспалительных молекул. Компании уже продавали имплантируемые стимуляторы для лечения эпилепсии.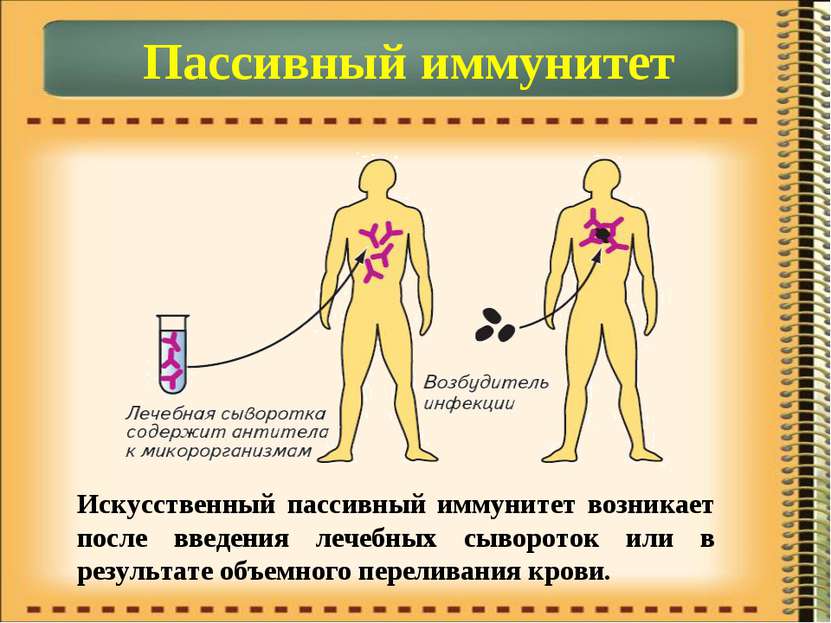 Но чтобы распространить эту технику на воспалительные заболевания, Трейси потребуется более четкое представление о том, как она может работать и каковы могут быть побочные эффекты.
Но чтобы распространить эту технику на воспалительные заболевания, Трейси потребуется более четкое представление о том, как она может работать и каковы могут быть побочные эффекты.
В течение следующих 15 лет команда Трейси провела серию экспериментов на животных, чтобы определить, где и как действует стимуляция блуждающего нерва. Они пытались перерезать нерв в разных местах4 и использовать препараты, блокирующие определенные нейротрансмиттеры5. Эти эксперименты, казалось, показали, что, когда блуждающий нерв поражается электричеством, сигнал проходит по нему в брюшную полость, а затем через второй нерв в селезенку.
Селезенка служит своего рода иммунологической остановкой грузовика, где циркулирующие иммунные клетки периодически паркуются на некоторое время, прежде чем вернуться в кровоток.Команда Трейси обнаружила, что нерв, входящий в селезенку, высвобождает нейромедиатор под названием норадреналин6, который напрямую взаимодействует с лейкоцитами селезенки, называемыми Т-клетками. Соединения между нервом и Т-клеткой на самом деле напоминают синапсы между двумя нервными клетками; «Т-клетки действуют почти как нейроны», — говорит Трейси. При стимуляции Т-клетки выделяют другой нейротрансмиттер, называемый ацетилхолином, который затем связывается с макрофагами в селезенке. Именно эти иммунные клетки обычно выбрасывают TNF-α в кровоток, когда животное получает эндотоксин.Однако воздействие ацетилхолина предотвращает выработку макрофагами воспалительного белка (см. «Шок для иммунной системы»).
Соединения между нервом и Т-клеткой на самом деле напоминают синапсы между двумя нервными клетками; «Т-клетки действуют почти как нейроны», — говорит Трейси. При стимуляции Т-клетки выделяют другой нейротрансмиттер, называемый ацетилхолином, который затем связывается с макрофагами в селезенке. Именно эти иммунные клетки обычно выбрасывают TNF-α в кровоток, когда животное получает эндотоксин.Однако воздействие ацетилхолина предотвращает выработку макрофагами воспалительного белка (см. «Шок для иммунной системы»).
Открытия Трейси придали новое значение исследованиям, которые велись десятилетиями. В 1980-х и 1990-х годах Дэвид Фелтен, нейроанатом из Университета Рочестера в Нью-Йорке, сделал микроскопические изображения гибридных синапсов нейрон-Т-клетки у различных животных7 — не только в селезенке, где их видела Трейси, но и в других. лимфатические узлы, тимус и кишечник.Эти нейроны принадлежат к так называемой симпатической нервной системе, которая регулирует реакцию организма на определенные стрессоры. Точно так же, как Трейси обнаружила в селезенке, Фельтен заметил, что эти симпатические нейроны стимулируют своих Т-клеточных партнеров, секретируя норадреналин — и часто эта стимуляция служит для ослабления воспаления.
Точно так же, как Трейси обнаружила в селезенке, Фельтен заметил, что эти симпатические нейроны стимулируют своих Т-клеточных партнеров, секретируя норадреналин — и часто эта стимуляция служит для ослабления воспаления.
В 2014 году нейроиммунолог Акико Накаи из Университета Осаки в Японии сообщил о доказательствах того, что стимуляция симпатических нервов Т-лимфоцитами ограничивает их выход из лимфатических узлов и попадание в кровоток, где они могут вызвать воспаление в других частях тела8.Но при многих аутоиммунных заболеваниях эта нервная сигнализация нарушена.
Лортон и ее сестра-близнец, нейробиолог Дениз Беллинджер из Университета Лома Линда в Калифорнии, обнаружили, что проводящие пути симпатического нерва изменяются на моделях аутоиммунных заболеваний на крысах9. То же самое и у людей. Симпатические нервы повреждаются из-за чрезмерного высвобождения норадреналина, что заставляет их выходить из иммунных клеток, которые они должны сдерживать. По мере прогрессирования болезни эти нервы продвигаются обратно в ткани, от которых они отказались, но делают это ненормальным образом, устанавливая связи с различными подмножествами иммунных клеток.Эти перестроенные нервные пути фактически поддерживают воспаление, а не ослабляют его. По словам Беллингера, это происходит в таких местах, как селезенка, лимфатические узлы и суставы, и вызывает множество патологий.
Но она, Лортон и другие скептически относятся к описанию Трейси пути, с помощью которого стимуляция блуждающего нерва снижает воспаление. Робин Макаллен, нейробиолог из Мельбурнского университета в Австралии, искал связи между блуждающим нервом и нервом, который стимулирует Т-клетки в селезенке, но пока ничего не нашел.
Стимуляция блуждающего нерва «действует косвенно» через другие нервы, говорит Беллингер. По ее словам, важно правильно нанести на карту эти нейронные цепи, прежде чем переходить к лечению у людей. «Анатомия имеет большое значение в том, какие побочные эффекты вы можете увидеть».
Тем не менее, даже эти скептики видят потенциал в методах Трейси. Беллинджер отмечает, что при многих аутоиммунных заболеваниях не только симпатические нервы становятся сверхактивными, поскольку они перестраиваются в провоспалительные цепи, но и блуждающий нерв, который им противостоит, становится неактивным.Стимуляция блуждающего нерва может частично восстановить баланс между этими двумя нервными системами. «Это первый шаг», — говорит она. «Я верю, что они представят его в клинике, и они покажут замечательные эффекты».
Подход к пациенту
Люди, получившие стимуляцию блуждающего нерва при судорогах или депрессии, испытывают некоторые побочные эффекты — например, боль и сжатие в гортани или напряжение в голосе; Катрин чувствует второстепенную версию этого, когда стимулирует свой блуждающий нерв.Шокирование этого нерва может также снизить частоту сердечных сокращений или увеличить кислотность желудочного сока, среди других эффектов.
В этом отношении у Трейси есть повод для оптимизма. Блуждающий нерв человека содержит около 100 000 отдельных нервных волокон, которые разветвляются и достигают различных органов. Но количество электричества, необходимое для запуска нейронной активности, может варьироваться от волокна к волокну в 50 раз.
Яаков Левин, бывший аспирант Трейси, выяснил, что нервные волокна, участвующие в уменьшении воспаления, имеют низкий порог активации.Их можно включить с помощью всего лишь 250-миллионных ампер — одной восьмой количества, которое часто используется для подавления припадков. И хотя людям, получающим лечение от судорог, требуется до нескольких часов стимуляции в день, эксперименты на животных показали, что однократный кратковременный разряд может надолго контролировать воспаление10. Макрофаги, пораженные ацетилхолином, не могут производить TNF-α в течение 24 часов, говорит Левин, который сейчас работает в Манхассете в SetPoint Medical, компании, созданной для коммерциализации стимуляции блуждающего нерва в качестве лечения.
К 2011 году SetPoint была готова опробовать эту технику на людях благодаря исследованиям на животных и усилиям Левина по оптимизации. Это первое испытание курировал Пол-Питер Так, ревматолог из Амстердамского университета и британской фармацевтической компании GlaxoSmithKline. В течение нескольких лет 18 людям с ревматоидным артритом были имплантированы стимуляторы, в том числе Катрин.
Она и 11 других участников отметили, что их симптомы улучшились в течение 6 недель.Лабораторные тесты показали, что уровень в их крови воспалительных молекул, таких как TNF-α и интерлейкин-6, снизился. Эти улучшения исчезли, когда устройства были отключены на 14 дней, а затем вернулись, когда стимуляция была возобновлена.
Катрин, которая с тех пор продолжает использовать стимулятор, по-прежнему принимает еженедельные инъекции противоревматического препарата метотрексат, а также ежедневную дозу противовоспалительной таблетки под названием диклофенак, но она смогла прекратить прием высоких доз. , иммунодепрессанты, и ее суставы улучшились настолько, что она могла вернуться к работе.Результаты этого исследования были опубликованы в июле прошлого года в журнале Proceedings of the National Academy of Sciences 11.
Примерно в то же время были опубликованы результаты другого исследования стимуляции блуждающего нерва12. Бруно Боназ, гастроэнтеролог университетской больницы в Гренобле, Франция, имплантировал стимуляторы семи пациентам с болезнью Крона. В течение шести месяцев пятеро из них сообщили о том, что у них меньше симптомов, а эндоскопия кишечника показала уменьшение повреждения тканей.SetPoint также находится в середине собственного клинического испытания с использованием стимуляции блуждающего нерва для лечения болезни Крона.
Трейси и Боназ — не единственные люди, которые хотят использовать нейронные цепи для лечения воспаления. Рауль Коимбра, хирург-травматолог из Калифорнийского университета в Сан-Диего, изучает его как способ лечения септического шока, от которого ежегодно страдают сотни тысяч людей. Многие люди, которые умирают от этого заболевания, преодолевают точку невозврата из-за единственного события: быстрого разрушения слизистой оболочки кишечника, в результате чего бактерии попадают в организм, вызывая воспаление, которое повреждает органы, включая легкие и почки.
Как и Трейси, Коимбра успешно противодействовала этой фатальной последовательности у животных, стимулируя блуждающий нерв либо электричеством13, либо введя экспериментальный препарат под названием CPSI-121 (ссылка 14). Коимбра надеется провести эту работу в клинических испытаниях. Но его исследование также выявило еще одну серьезную проблему, которую необходимо преодолеть при стимуляции блуждающего нерва: в отличие от крыс, некоторые люди, вероятно, устойчивы к этой технике.
Геном человека кодирует дополнительный нефункционирующий белок рецептора ацетилхолина, которого нет у других животных.Тодд Костантини, сотрудник Коимбры из Калифорнийского университета в Сан-Диего, обнаружил, что если этот аномальный рецептор вырабатывается в достаточных количествах, он может нарушить передачу сигналов и сделать макрофаги невосприимчивыми к ацетилхолину. Затем они могут продолжать высвобождать TNF-α, несмотря на стимуляцию блуждающего нерва15. По словам Костантини, количество этого белка, производимого людьми, может быть увеличено в 200 раз. Он планирует проверить людей, чтобы определить, действительно ли высокие уровни блокируют противовоспалительные эффекты стимуляции блуждающего нерва.Неофициальные данные свидетельствуют о том, что это могло быть так.
Небольшие клинические испытания, проведенные на данный момент, показали, что некоторые люди не реагируют на стимуляцию блуждающего нерва. Возможно, тестирование поможет определить, кому будет полезно лечение, до того, как люди получат имплантаты.
Тем не менее, несмотря на неопределенность, область электрокцевтики начинает набирать обороты. В октябре прошлого года Национальный институт здравоохранения США объявил о программе под названием «Стимулирование периферической активности для облегчения состояний» (SPARC), которая предоставит до 2021 года финансирование в размере 238 миллионов долларов США для поддержки исследований, обновляющих карты нейронных цепей в грудной и брюшной полостях.
GlaxoSmithKline также проявляет интерес. Она инвестировала в SetPoint и в прошлом году объявила о создании совместного предприятия с Google под названием Galvani Bioelectronics, которое будет разрабатывать методы лечения ряда состояний, включая воспалительные заболевания.
Еще неизвестно, оправдывает ли стимуляция блуждающего нерва ожидания. Число людей, прошедших курс лечения, невелико — всего 25 человек в 2 завершенных испытаниях. И лечение часто выглядит многообещающим в ранних испытаниях, таких как эти, но затем проваливается в более крупных.
Но люди с аутоиммунными заболеваниями начинают обращать на это внимание. Лечение ревматоидного артрита и болезни Крона сопряжено с определенным риском и помогает не всем. Катрин была одной из более чем 1000 человек, интересовавшихся исследованием стимуляции блуждающего нерва. «У меня больше ничего не было», — говорит она. «Я хотел этого».
Примечание редактора: в более ранней версии этой статьи ошибочно предполагалось, что Кевин Трейси инициировал первое испытание стимуляции блуждающего нерва при ревматоидном артрите у людей.Это была SetPoint Medical, компания, которую он основал. Кроме того, Пол-Питер Так, руководивший испытанием, впервые присоединился к GlaxoSmithKline в 2011 году, а не в 2016 году.
Эта статья воспроизводится с разрешения и впервые была опубликована 3 мая 2017 года.
Как микробы тренируют нашу иммунную систему: Nature News
Кишечные бактерии уговаривают Т-клетки видеть в них друзей.
Не убивайте своих друзей. Общая больница Саутгемптона / SPLСогласно исследованию, опубликованному сегодня в журнале Nature 1 , микробы, живущие в толстой кишке мышей, уговаривают иммунные клетки хозяина принять их, а не вызывать иммунный ответ.Этот процесс происходит не в специализированном органе, называемом тимус, где обычно тренируются такие иммунные клетки, а прямо на дворе микробов: в кишечнике.
Полученные данные свидетельствуют о том, что такие болезни, как язвенный колит и болезнь Крона, могут разжигаться, когда этот процесс идет наперекосяк.
Одной из основ способности иммунной системы отражать атакующих является ее способность отличать собственные клетки от чужеродных. Эту задачу в значительной степени выполняет тип иммунной клетки, называемой Т-клеткой.
Вырабатываются незрелые Т-клетки, несущие широкий спектр рецепторов, Т-клеточные рецепторы, которые распознают огромное количество химических структур, в данном контексте известных как антигены. Тренировка Т-клеток происходит в тимусе, где они представлены большим количеством различных «собственных» антигенов — антигенов, характерных для самого животного, а не для микроорганизмов.
Т-клетки с рецепторами, распознающими эти аутоантигены, либо удаляются, либо развиваются в регуляторные Т-клетки, которые затем циркулируют по организму, подавляя любой потенциальный иммунный ответ против собственных тканей животного.Остальные Т-клетки развиваются в эффекторные Т-клетки, играющие ключевую роль в запуске иммунного ответа на все, что не распознается как собственное.
Друг или враг?
Однако не все инородные частицы в теле подлежат уничтожению. Микробы, живущие в организме безвредно и часто приносящие пользу, избегают гнева иммунной системы, но исследователи не знают, как это сделать. Чи-Сон Се из Медицинской школы Вашингтонского университета в Сент-Луисе, штат Миссури, и его коллеги теперь сообщают, что эти микробы, похоже, обеспечивают локализованные инструкции в кишечнике, сообщая незрелым Т-клеткам, которые распознают их, превращаться в регуляторные Т-клетки.
Предыдущая работа предполагала, что регуляторные Т-клетки могут быть индуцированы вне тимуса, но это первая демонстрация того, что такие периферически генерируемые клетки действительно существуют, говорит Кения Хонда, иммунолог из Медицинской школы Токийского университета, который не принимал участия в исследовании. изучение.
Hsieh и его коллеги обнаружили, что аминокислотные последовательности регуляторных Т-клеточных рецепторов в толстой кишке мыши отличаются от таковых рецепторов Т-клеток в других органах.«Это говорит о том, что в толстой кишке есть что-то совсем другое с точки зрения представленных антигенов», — объясняет Се.
Группа продолжила исследовать, генерируются ли антигены, на которые реагируют регуляторные Т-клетки толстой кишки, бактериями или клетками мыши. Исследователи использовали вирусный вектор для переноса генов двух рецепторов от Т-клеток из толстой кишки мышей в костный мозг (откуда происходят Т-клетки) мышей, которые были генетически модифицированы так, чтобы не иметь собственных Т-клеток.Обработанный костный мозг генерировал незрелые иммунные клетки, несущие эти рецепторы, но эти клетки не созрели в регуляторные Т-клетки, как ожидалось.
Дополнительные эксперименты показали, что это произошло из-за того, что у мышей-реципиентов, которые были заказаны у поставщика мышей, в толстой кишке были бактерии, отличные от мышей, выращенных в лаборатории Се и у которых были взяты гены рецепторов Т-клеток. Когда две линии мышей были размещены вместе, что позволило переносить кишечные бактерии между ними, иммунные клетки реципиентов действительно созрели в регуляторные Т-клетки.
Hsieh говорит, что это означает, что кишечные бактерии должны были запустить иммунные клетки, распознавшие их, для созревания в регуляторные Т-клетки, гарантируя, что бактерии будут защищены от иммунного ответа своего хозяина.
Предотвращение воспаления
Наконец, исследователи заметили, что у мышей с колитом рецепторы, обычно присутствующие на регуляторных Т-клетках толстой кишки, вместо этого присутствовали на эффекторных Т-клетках. «Таким образом, если у вас не разовьется регуляторная Т-клеточная реакция, вы действительно можете вызвать воспалительную реакцию на эти бактерии», — говорит Се.
«Это интенсивное исследование, которое систематически исследует эти сигналы, которые направляют дифференциацию на периферии», — говорит Ивайло Иванов, иммунолог из Медицинского центра Колумбийского университета в Нью-Йорке, который не принимал участия в исследовании. «Идея здесь в том, что комменсальные бактерии по какой-то причине предпочтительно индуцируют регуляторные Т-клетки, которые затем вызывают толерантность к этим бактериям».
ОБЪЯВЛЕНИЕ
Как именно это происходит, пока неизвестно, но Се говорит, что его лаборатория работает над этим вопросом.Полученные на данный момент результаты предполагают, что может существовать механизм, который различает два разных типа чужеродных бактерий — вредные и дружественные.

