Влияние ртути на организм человека
Как известно, при комнатной температуре ртуть является жидкостью. В результате происходит постоянное и непрерывное испарение атомов с ее поверхности. Ртуть в газообразном состоянии может месяцами задерживаться в атмосфере, со временем, постепенно, она совершает круговорот и возвращается в почву, выпадая вместе с дождевой водой. Даже находясь в твердом агрегатном состоянии или в сплавах с другими металлами атомы ртути постоянно улетучиваются в атмосферу. О том, какое влияние ртуть оказывает на организм человека, мы поговорим в этой статье.
Ртуть — переходный металл, в природе образует целый ряд минералов, и в то же время находится в природе в самородном виде. Это редкоземельный элемент, его средняя концентрация 0,08 частей на миллион. Во сравнению с обычными породами, ртутные руды во многих случаях более концентрированны, это объясняется тем, что ртуть плохо вступает в химические соединения с элементами, которые имеют наибольшее распространение в земной коре.
| Рис. 1 Шарики ртути на доске |
Вплоть до XX века выбросы ртути в атмосферу и обеспечивали и её осаждение выпадение из атмосферы в виде осадков, составляло около 4 нг на литр воды при температуре ноль градусов. Примерно половина всех выбросов ртути в атмосферу обеспечивается природными источниками: вулканами и пожарами. Остальные 50 % — последствия техногенной деятельности человека: выбросы ТЭЦ в результате работы на различных углях составляет 65 % от всего объёма выбросов, выплавка благородных и цветных металлов — 17,8 %, производство строительных материалов в частности цемента — 6,4 %, используемые методы утилизации, в том числе и сжигание мусора — 3 %, при производстве соды — 3%, производство металлов (стали и чугуна) — 1,4 %.
РТУТЬСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Ртуть и ее соединения применяются во многих отраслях народного хозяйства: технике, химической и фармацевтической промышленности, в медицинской практике. Известное соединение каломель, буквально переводится с греческого как красивый (καλός) и чёрный (μέλας) Hg2Cl2 — редкий минерал, относится к классу галогенидов, является хлоридом ртути (I), применяется в пиротехнике.
Очень токсичным является хлорид ртути (II), называемый сулемой, ранее применялась и использовалась в медицине как дезинфицирующее и противомикробное средство: наружно в виде мазевых форм при заболеваниях роговицы глаза, бленнорее, а также применялось местно для профилактики и лечения венерических заболеваний. В некоторых случаях использовалось для применения внутрь как желчегонное средство. В силу токсичности настоящее время в медицинской практике вытеснен более современными препаратами.
Необходимо сказать, что ртутная мазь или ртутные мази является собирательным названием ряда лекарственных препаратов, которые содержат, в том или ином проценте, ртуть или соединения ртути с другими металлами. Именно из — за очень высокой биологической активности ртути и её соединений — способности инактивировать сульфгидрильные группы ферментов, её и использовали в качестве лекарственного средства уже с древнейших времён. Термин антисептическое действие был введён 265 лет назад английским врачом Дж. Принглом, который описал его у хинина. Этот термин подразумевает ряд последовательных мероприятий, которые направлены на уничтожение микробной флоры в ранах, в очагах воспалений, а та же в организме в целом при помощи различных методов и способов: механические и физические, а так же применение различных биологических факторов и химических веществ. Естественно, что древние врачи не осознавали действие ртути и её соединений именно в таком плане, как комплекс мероприятий, но знания, накопленные империческим путём, показывали эффективность применения мазей содержащих ртуть и её соединений.
В древнюю Русь, применение соединений ртути при лечении эпидемических заболеваний пришло из Индии — «ртутные мазуни» использовали при лечении кожных заболеваний, а так же как одно из эффективных средств избавления от кожных паразитов, метод дошедший до наши дней — Unguentum Hydrargyri cinereum (мазь ртутная серая). Препарат применяющийся наружно, обладающий антисептическим и противовоспалительным действием. Показания к применению: паразитарные заболевания (фтириаз — педикулёз вызываемый лобковой вошью). Мазь состоит (расчёт на 100 г ): очищенного животного жира — 60,0 г, концентрированной ртутной мази — 35,7 г, ланолина безводного — 4,3 г. Можно сравнить рецепт — пропись из древних индийских ведийских текстов — мазь готовили методом перетирания серы, металлической ртути и животного жира.
Амидохлорид ртути является действующим компонентом некоторых косметических средств применяемых постепенного шелушения.
В ветеринарии мази содержащие ртуть применяются как наружные средства при паразитарных заболеваний кожи.
Применяется в технологиях чернения и травления стали, для производства каломельных электродов, применяется как катализатор органических реакций, для производства некоторых видов чернил, а так же для обработки деревянных стройматериалов. Сулема, как и многие другие органические соединения ртути, применяется в сельском хозяйстве, с её помощью производят протравливание семян (посевного материала) при хранении и широко используются в качестве пестицидов.
Нитрат ртути используется в кожевенной промышленности, при производстве фетровых шляп и для отделки меховых изделий, в химической промышленности для серебрения зеркал и получения других соединений ртути. По токсичности нитрат ртути сопоставим с токсичностью сулемы.
На производствах где в технологическом цикле применяются ртуть и её соединения у рабочих, занятых в цикле производства, часто наблюдались психические нарушения.
На сегодняшний день в повседневной жизни мы сталкиваемся с ртутью обычно в таких случаях:
• вставляя зубные пломбы, содержащие амальгаму (Рис 2),
• используя вакцины, в составе которых содержится мертиолят,
• при употреблении в пищу морепродуктов,
• при использование приборов содержащих ртуть (ртутьсодержащие лампы, градусники, батарейки и т. п.)
В стоматологи применение амальгам в наше время обусловлено тем, что до настоящего времени это соединение является одним из наиболее прочным и устойчивым пломбировочным материалом и применяется в врачами — стоматологами уже более века. За столь длительный период составы амальгам претерпели многие и существенные изменения. В современной стоматологии применяется медная и серебряная амальгама с целью воспрепятствовать бактериальному загрязнению. Элементарная ртуть, постепенно освобождаясь из амальгамы зубных пломб, вдыхается и поглощается легкими, как правило в 80 % случаев и аккумулируется в организме.
Амальгамы — это сплавы ртути (жидкие или твердые) с другими металлами. Такие сплавы применяют в технологии золочения металлических изделий, в производстве зеркал, для извлечения некоторых металлов из руд, при холодной сварке в микроэлектронике.
При производстве вакцин, на одном из технологических этапов, добавляется тимеросал, который в своём составе содержит 50% метил ртути. Метилртуть — белое порошкообразное вещество, имеет характерный запах серы, является органическим соединением ртути ароматического ряда. В производстве фармацевтических препаратов мертиолят получил широкое распространение в силу ярко выраженных антисептических, бактерицидных, фунгицидных свойств. Используется как консервант в вакцинах, препаратах иммуноглобулинов (антител), антидотов (противоядиях), кожных пробах на аллергию, в некоторых препаратах для глаз и слизистой носа, а также в красках для татуировки.
Имеет высокую токсичность, проявляет себя как канцероген, мутаген, тератоген. Мертиолят крайне опасен при попадании в организм. Пути проникновения в организм: ингаляционно, через кожные покровы или с пищей. Для мышей при подкожном введении средняя летальная доза (LD50) составляет 66 мг/кг и всего лишь меньше на 21 мг/кг при внутривенном введении — 45 мг/кг.
Мертиолят крайне опасен при попадании в организм. Пути проникновения в организм: ингаляционно, через кожные покровы или с пищей. Для мышей при подкожном введении средняя летальная доза (LD50) составляет 66 мг/кг и всего лишь меньше на 21 мг/кг при внутривенном введении — 45 мг/кг.
В большинстве вакцин используемых в Российской Федерации мертиолят содержится в незначительной концентрации 1:10000. Соответственно, в прививочной дозе, которая составляет 0,5 мл вакцины, содержится незначительный объём мертиолята — 0,05 мг
Рыба, как и многие морепродукты содержат другую, но не менее опасную, органическую форму ртути, которая явилась причиной массовых отравлений — метилртуть. Промысловая рыба и моллюски получают эту форму из планктона, который включён в их пищевую цепочку. Планктон, в свою очередь, это соединение синтезирует из извлеченной из моря неорганической ртути. Такова этиология возникновения отравлений морепродуктами.
ПОВРЕЖДЕНИЯ МОЗГА ПРИ ОТРАВЛЕНИИ РТУТЬЮ
Согласно исследованиям, степень и тяжесть повреждений мозга и сердца определенной дозой ртути зависят от многих факторов: возраста, пола и генетически обусловленной способности человека выводить ртуть и её соединений из организма.
Американские исследователи помещали пломбы из амальгамы, содержащих радиочип, в зубы овец и с помощью сканнера удалось определять концентрацию ртути, которая улетучивалась. Выяснилось, что основная масса атомов ртути, испаряется через нос. При испарении они проходили путь вдоль обонятельного нерва к непосредственно в область гиппокампуса, органа, контролирующего память, а также проникали в другие важные области мозга.
В других исследованиях крысы получали ртуть в таких концентрациях, которые были аналогичны вдыхаемой концентрации людьми из пломб имеющих в составе амальгаму. Через некоторое время у таких крыс были определены патологические маркеры болезни Альцгеймера.
По наблюдениям ученых-генетиков, гены, полученные от родителей, определяют два фермента, продуцируемые организмом. Люди, получившие по наследству два фермента АР0-Е4 (и, следовательно, не имеющие ни АРО-Е2, ни АРО-ЕЗ генов), имеют 80-и процентную вероятность заболеть болезнью Альцгеймера. Первые симптомы болезни: люди испытывают затруднения при необходимости концентрации внимания, а так же происходит потеря памяти различной степени, что в дальнейшем приводит к разрушению психики. Согласно проведённым исследованиям, у страдающих аутизмом детей в мозге наблюдается доминирование именно ферментов АР0-Е4.
|
Рис. |
У людей страдающих болезнью Альцгеймера наблюдается уменьшение мозга и его структур на 25 %. При обследовании обнаружены патологические признаки, которые исключительно характерны для этой болезни (амилоидные бляшки, нейрофибриллярные узелки и фосфорилированные тау-белки). В одном из проведённых экспериментов, клетки мозга, выращенные в лабораторных условиях, подвергались воздействию наномолярными дозами ртути (3,6 х 10-10 моль), при дальнейшем исследовании были обнаружены такие же три, вышеуказанные патологические признаки, характерные для болезни Альцгеймера. В независимом, другом исследовании в мозге людей имевших много пломб, в состав которых входила амальгама (Рис. 2), было обнаружено такое же количество ртути. Установлено, что основным источником ртути в мозге взрослых людей, является амальгама из зубных пломб. В зубной пломбе среднего размера из амальгамы содержится 750 000 мкг ртути, при этом каждый день высвобождается приблизительно 10 мкг. Это ничтожно малые количества, но как было уже сказано, ртуть и её соединения могут накапливаться в организме человека.
Установлено, что основным источником ртути в мозге взрослых людей, является амальгама из зубных пломб. В зубной пломбе среднего размера из амальгамы содержится 750 000 мкг ртути, при этом каждый день высвобождается приблизительно 10 мкг. Это ничтожно малые количества, но как было уже сказано, ртуть и её соединения могут накапливаться в организме человека.
ОСОБЕННОСТИ ОСТРЫХ И ХРОНИЧЕСКИХ ОТРАВЛЕНИЙ РТУТЬЮ
Острое отравление ртутью возникает при массированном попадании ртути или её соединений в организм человека через верхние дыхательные пути, желудочно-кишечный тракт, а так же проникновение через кожные покровы. Морфологически интоксикация проявляется в виде множественных, массивных некрозов в желудке, толстом кишечнике и острого тубулярного некроза почек — нарушение функции почек с резким снижением процессов реабсорбции и фильтрации, которые приводят к расстройству водного, электролитного, азотистого и других видов обмена. Появляется резко выраженная отёчность. До настоящего времени не отмечалось и не выявлено никаких характерных повреждений головного мозга от воздействия соединений ртути.
До настоящего времени не отмечалось и не выявлено никаких характерных повреждений головного мозга от воздействия соединений ртути.
| Рис. 3 Металлическая ртуть находится в медицинских термометрах, содержание до 2 гр |
Хроническая интоксикация ртутью, в отличии от острой, клинически имеет более характерные изменения. Возникает гиперсалевация — обильное слюновыделение, меняется цвет десён, т. к. ртуть, скопившаяся у краёв десен, вызывает гингивит с дальнейшим развитием пародонтита, проявляется как кровоточивость, расшатыванием и выпадением зубов. Часто развивается хронический гастрит, сопровождающийся изъязвлениями слизистой, нарушается работа почек.
Металлическая ртуть (Hg) находится в медицинских термометрах — 2 гр (Рис. в каждом, в некоторых других медицинских приборах — аппарат Рива-Роччи, где индикатором артериального давления служил ртутный манометр, ртутьсодержащих электрических элементах, зубных пломбах.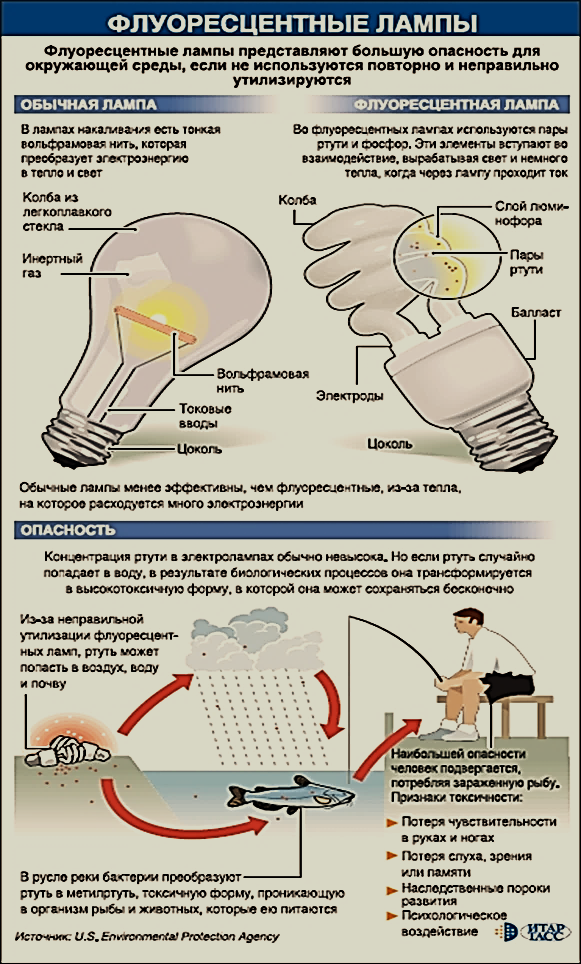 Одновалентная (Hg+) и двухвалентная (Hg2+) ртуть входит в состав очень многих органических и неорганических соединений, которые представляют собой соли и окиси. Все эти три формы, металлическая, одно-, и двухвалентная ртуть ядовиты, но в различной степени.
Одновалентная (Hg+) и двухвалентная (Hg2+) ртуть входит в состав очень многих органических и неорганических соединений, которые представляют собой соли и окиси. Все эти три формы, металлическая, одно-, и двухвалентная ртуть ядовиты, но в различной степени.
В природе расппад органических соединений ртути до неорганических происходит медленно. Неорганические соединения ртути могут постепенно превращаться водными и почвенными микроорганизмами в органическое соединение — метилртуть. Иногда такие соединения ртути могут накапливаться в опасных для здоровья концентрациях в рыбе, особенно в таких видах как меч-рыба и тунец
Именно употребление море продуктов, зараженных ртутью, попавшей в прибрежные воды из промышленных отходов предприятий, привело в 1955 году к массовому ртутному отравлению в небольшом японском прибрежном городе Минамата.
Рис. 4 Аппарат Рива – Роччи (ртутный сфигмоманометр) для определения артериального кровяного давления. |
По официальным данным японского Национального института по изучению болезней, причиной массовых отравлений было употребление большого количества рыбы и моллюсков, зараженных метилртутью, которая сбрасывалась в залив Минамата. Болезнь эта не является инфекционной или генетической. Морские организмы, которым ядовитые соединения не наносили вреда, являлись аккумуляторами смертельных доз соединений ртути и их передатчиками. Официально болезнь Миномата была установлена в 1956 году и только спустя 12 лет, в 1968-м году национальное правительство решилось объявить, что ответственной за эти массовые отравления является фирма «Чиссо Ко., Ltd». При массированном попадании в организм метилртуть главным образом и в первую очередь воздействует на центральную нервную систему. Симптомами являются онемение верхних и нижних конечностей и их слабость, дрожание рук, ног и даже всего тела — ртутный тремор, быстрая и хроническая усталость, головные боли, повышенная возбудимость, звон в ушах, нарушение периферического (бокового) поля зрения, т. е. его сужение до небольшого островка в центральной области, ощущение видения окружающего мира, через трубку малого диаметра, потеря слуха, неуклюжие движения — нарушение координации, дизартрия — нечленораздельная речь, пульс неустойчивый, тахикардия. В тяжёлых случаях отравления, некоторые из жертв болезни Минамата, охватившей город, сходили с ума и умирали в течение месяца. При хроническом течении заболевания симптомы этой болезни — частая и практически постоянная усталость, снижение работоспособности, головные боли, потеря и отсутствие вкуса и обоняния, ухудшение памяти и забывчивость, не смертельны, однако чрезвычайно осложняют и затрудняют повседневную жизнь.
е. его сужение до небольшого островка в центральной области, ощущение видения окружающего мира, через трубку малого диаметра, потеря слуха, неуклюжие движения — нарушение координации, дизартрия — нечленораздельная речь, пульс неустойчивый, тахикардия. В тяжёлых случаях отравления, некоторые из жертв болезни Минамата, охватившей город, сходили с ума и умирали в течение месяца. При хроническом течении заболевания симптомы этой болезни — частая и практически постоянная усталость, снижение работоспособности, головные боли, потеря и отсутствие вкуса и обоняния, ухудшение памяти и забывчивость, не смертельны, однако чрезвычайно осложняют и затрудняют повседневную жизнь.
Неорганические соединения ртути.
Такие соединения достаточно легко всасываются через кожу и в желудочно-кишечный тракт. При попадании в значительных дозах повреждают стенки кишечника, что приводит к еще большей интенсификации процесса проникновение. После всасывания происходит распад с образованием металлической и двухвалентной ртути. Благодаря строению и химическим особенностям неорганических соединений, лишь незначительное количество ртути проходит через гематоэнцефалический барьер. В основном же она выводится из организма или накапливается в почках.
Благодаря строению и химическим особенностям неорганических соединений, лишь незначительное количество ртути проходит через гематоэнцефалический барьер. В основном же она выводится из организма или накапливается в почках.
Органические соединения ртути.
Эти производные ртути очень токсичны, особенно метилртуть, являются летучими и легко проникают через легкие. При вдыхании паров ртути наблюдаются симптомы острого бронхита и пневмонии. При попадании в желудок (например, с зараженными морепродуктами) они легко всасываются. Органические соединения являются жирорастворимыми. Именно липидорастворимость метилртути обуславливает её высокую токсичность, даже при попадании в организм человека в малых дозах. Это свойство обеспечивает достаточно легкое проникновение через биологические мембраны, попадать в головной и спинной мозг, а так же в периферические нервы. Такие соединения, у беременных женщин, пересекают плацентарный барьер и накапливаться в плоде. Метилртуть может попадать и в грудное молоко кормящих матерей и накапливаться до опасного уровня в крови у детей. Метилртуть, попадая в нервные клетки ЦНС производит их полную деструкцию и этот процесс практически необратим. Требуется чрезвычайно длительное лечение с целью хотя бы уменьшения или снижения последствий.
Метилртуть может попадать и в грудное молоко кормящих матерей и накапливаться до опасного уровня в крови у детей. Метилртуть, попадая в нервные клетки ЦНС производит их полную деструкцию и этот процесс практически необратим. Требуется чрезвычайно длительное лечение с целью хотя бы уменьшения или снижения последствий.
ГИГИЕНИЧЕСКИЕ НОРМЫ КОНЦЕНТРАЦИИ РТУТИ
Предельно допустимые концентрации или уровень загрязненности металлической ртутью и ее парами:
— населенные пункты (среднесуточная) — не выше 0,0003 мг/м3;
— жилые помещение (среднесуточная) — не выше 0,0003 мг/м3;
— воздух в рабочей зоне (максимальная разовая) — не выше 0,01 мг/м3;
— воздуха в рабочей зоне (среднесменная) — не выше 0,005 мг/м3;
— сточные воды (промышленные, для неорганических соединений) — 0,005 мг/мл;
— водные объекты культурного и хозяйственно-питьевого водопользования — не выше 0,0005 мг/л;
— рыбохозяйственные водоемы — не выше 0,00001 мг/л;
— морские водоемы — не выше 0,0001 мг/л;
— в слоях почвы — не выше 2,1 мг/кг.
ЛЕЧЕБНЫЕ МЕРОПРИЯ ПРИ ОТРАВЛЕНИЯХ РТУТЬЮ
При интоксикации ртутью или ртуть содержащими соединениями терапия должна быть комплексной и дифференцированной и учитывать выраженности и особенности патологического процесса. При острой интоксикации проводится экстренная госпитализация, при хронических интоксикациях стационарное лечение обеспечивается в начальных стадиях в дальнейшем проводится амбулаторное или санаторное лечение. В случае выявления профессионального отравления работника необходимо перевести на другие виды работу.
В терапии при отравлении ртутью применяются симптоматическое лечение основные лекарственные препараты: унитиол, таурин, метионин, димеркаптопропансульфонат натрия, димеркаптосукциновая кислота, аллитиамин.
В случае появления признаков отравления ртутью в быту или на предприятии, для оказания квалифицированной помощи, необходимо вызвать медицинских работников. До прибытия врачебной бригады пострадавшему необходимо несколько раз провести промывание желудка водой, предварительно добавив активированного угля — 20-30 г. Далее дают выпить литр молока, после этого рекомендуется взбить яичный белок с водой, несколько яиц на 0,5 литра и дать слабительное. После проведения мероприятий первой помощи, в ожидании медицинской помощи, пострадавшего необходим разместить в проветриваемом помещении с принудительной вентиляцией и обеспечить полный покой.
Далее дают выпить литр молока, после этого рекомендуется взбить яичный белок с водой, несколько яиц на 0,5 литра и дать слабительное. После проведения мероприятий первой помощи, в ожидании медицинской помощи, пострадавшего необходим разместить в проветриваемом помещении с принудительной вентиляцией и обеспечить полный покой.
| Рис. 5 Проведение мероприятий демеркуризации |
При лечении ртутных интоксикаций (кроме специальных медицинских мероприятий и лекарственных препаратов), а также для профилактики рекомендуется диета с употреблением продуктов с большим содержанием пектинов и альгинатов — веществ растительного происхождения, которые способствуют выведению из организма солей тяжелых металлов и ртути в том числе.
Демеркуризация Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией (Рис. 5) В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
5) В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Запрет использования ртутьсодержащей продукции
С 2020 года международная конвенция, названная в честь массового отравления ртутью и подписанная многими странами, запрещает производство, экспорт и импорт нескольких различных видов ртутьсодержащих продукции применяемой в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.
По материалам печати журнала «СанЭпидем контроль»
подводные камни. Взгляд глазами химика / Хабр
Написать эту статью меня сподвиг пост NotSlow Не так страшен жидкий металл. Там все просто: подстраховался от замыкания, нанес тонким слоем, прикрутил и радуйся низким температурам. Но так ли все хорошо на самом деле?
Там все просто: подстраховался от замыкания, нанес тонким слоем, прикрутил и радуйся низким температурам. Но так ли все хорошо на самом деле?
Для начала нужно выяснить, что это за жидкий металл такой. Среди чистых металлов единственный, который может быть жидким при комнатной температуре — это ртуть. В здравом уме никто сейчас не станет применять ртуть в качестве термоинтерфейса из-за ее крайней токсичности и испаряемости. Два других становятся жидкими уже при температуре человеческого тела — это цезий и галлий. Цезий — это «фтор наоборот» по своей химической активности, он возгорается и взрывается от малейших следов воздуха и влаги и даже разрушает стекло. Остается галлий (на КПДВ именно он). При комнатной температуре галлий все же твердый, однако с некоторыми другими легкоплавкими металлами он образует эвтектики, плавящиеся при 20,5°С (галлий-олово) и даже 15,3 °С (галлий-индий). Еще ниже — в районе 5 °С — плавится тройная эвтектика галлий-индий-олово (62, 25 и 13% соответственно). Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Исходя из этого, ясны и подводные камни. Первый из них — это абсолютная несовместимость галлийсодержащих сплавов с алюминием!
Во времена, когда уроки химии в школе непременно сопровождались демонстрацией опытов, был среди них и опыт по амальгамированию алюминия. Алюминий покрывали слоем ртути и он тотчас начинал бурно окисляться, рассыпаясь прямо на глазах. Ртуть защищала алюминий от образования оксидного слоя и он образовывался уже на поверхности амальгамы, но не был способен остановить окисление, так как на поверхности жидкости он не удерживался сплошным слоем, растрескивался, и в трещинах открывалась свежая, неокисленная поверхность амальгамы.
Ровно так же действует и галлиевый сплав с той только разницей, что он способен буквально пропитывать алюминий насквозь, проникая в межкристаллитные промежутки. Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках.
Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках.
Так что ЖМ следует держать от алюминия подальше. И это касается не только алюминиевых радиаторов: случайная капелька «жидкого металла» может уничтожить и корпус ноутбука, если тот из алюминиевого сплава, и любую другую алюминиевую деталь. Хотя бы корпус какого-нибудь конденсатора. Причем капелька эта является классическим катализатором — делает свое черное дело, не расходуясь сама.
Но и медь к галлию небезразлична. На рисунке выше я привел T-x диаграмму системы медь-галлий (из справочника «Диаграммы состояния двойных металлических систем» под ред. Лякишева), на которой видно бесчисленное множество интерметаллических соединений. Как только галлий вступит в контакт с медью, они тут же начинают образовываться. Жидкий галлий (к его сплавам это тоже относится) вообще очень охотно смачивает и металлы, и неметаллы, а явное химическое сродство этому крайне способствует. Так что «жидкий металл» будет просто впитываться в медь, образуя на границе между металлами корку интерметаллидов. Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Кстати, впитываемость галлия и его сплавов в металлы еще касается паяных соединений — помните про ту маленькую капельку, которая может разрушить алюминиевый корпус? Так вот, такая же капелька, попавшая на припой, сделает и его хрупкой, а пайку ненадежной. В какой-то момент это «сработает». Поэтому лично я бы держал «жидкий металл» как можно дальше от любой электроники.
И последнее, о чем следовало бы написать: «жидкий металл», увы, небезвреден. Галлий по некоторым данным сравним по токсичности с мышьяком, второй его компонент, индий — также является токсичным тяжелым металлом. В отличие от ртути сплавы на основе галлия все же абсолютно нелетучи при обычной температуре, так что отравиться их парами не получится, однако из-за своей способности легко прилипать ко всему на свете эти сплавы невероятно мазучие. Испачкать ими, к примеру, руки — легче легкого, а отмыть их до конца очень сложно. Потом это все попадет в рот. Поэтому — работаем с «жидким металлом» и всем, что с ним контактировало только в резиновых перчатках и отдельно от еды, питья и курения. И да, никогда не делайте так, как на КПДВ!
Жидкометаллические теплоносители. — 1967 — Электронная библиотека «История Росатома»
Жидкометаллические теплоносители. — 1967 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульные листы
3Предисловие ко второму изданию
4Предисловие к первому изданию
5Глава 1. Основные свойства жидких металлов
5[Введение]
51. Строение и структура жидких металлов
82. Химические свойства
133. Основные физические свойства жидких металлов
184. Обобщенные зависимости характеристических свойств жидких металлов
325. Смесь жидких металлов
34Глава 2. Применение жидкометаллических теплоносителей
34[Введение]
351. Применение жидкометаллических теплоносителей в паросиловых установках
372. Применение жидкометаллических теплоносителей в ядерных энергетических установках
373. Использование жидкометаллических теплоносителей с целью интенсификации тепловых процессов
38Глава 3. Некоторые вопросы гидродинамики
381. Течение жидких металлов в гладких трубах
412. Течение в шероховатых трубах
433. Влияние теплового потока
444. Местные сопротивления
Местные сопротивления
465. Трение вращающегося диска
476. Повышение давления при гидравлическом ударе
487. Влияние смачиваемости стенки на структуру и гидродинамические характеристики паро-жидкостной смеси
538. Барботаж
609. Течение жидких металлов при температурах, близких к температуре затвердевания
6210. Влияние магнитного поля на гидравлику жидких металлов
65Глава 4. Турбулентный перенос тепла в жидких металлах
651. Классификация теплоносителей по величине числа Прандтля
662. Связь между турбулентной вязкостью и турбулентной теплопроводностью в плоском потоке несжимаемой жидкости
683. Коэффициенты неподобия рассеяния теплосодержания и количества движения
78Глава 5. Теплоотдача при течении жидкометаллического теплоносителя в трубах с постоянным поперечным сечением
781. Ламинарное течение. Теория
812. Турбулентное течение. Теория
903. Экспериментальные данные о теплоотдаче к ртути
1154. Экспериментальные данные о теплоотдаче к эвтектике Pb—Bi
1265. Экспериментальные данные о теплоотдаче к олову
Экспериментальные данные о теплоотдаче к олову
1276. Экспериментальные данные о теплоотдаче к щелочным металлам
1477. Сопоставление опытных данных о теплоотдаче в трубах
147[Введение]
153Физико-химические условия
154Расчетные рекомендации
1578. Сопоставление опытных данных о теплоотдаче при течении теплоносителя в щелях
1609. Теплоотдача при наличии внутренних источников тепла в потоке жидкости
163Глава 6. Теплоотдача при продольном обтекании пластины
1631. Некоторые особенности теплообмена при обтекании тела потоком жидкости с числом Pr
1652. Обтекание пластины ламинарным пограничным слоем
1683. Обтекание пластины турбулентным пограничным слоем
181Глава 7. Теплоотдача при поперечном и продольном обтекании пакетов труб
1811. Теплоотдача при обтекании фронтальной части одиночного цилиндра вязкой жидкостью с числом Pr
1862. Некоторые экспериментальные данные по локальной и средней теплоотдаче при поперечном обтекании труб
1933. Теплоотдача при продольном обтекании пакета труб
Теплоотдача при продольном обтекании пакета труб
212Глава 8. Теплоотдача при свободной конвекции
2121. Характер связи между основными безразмерными параметрами при числе Pr
2142. Теоретическое решение для вертикальной плиты в области развитого ламинарного пограничного слоя
2163. Экспериментальные данные о свободной конвекции в неограниченном объеме
2214. Свободная конвекция в ограниченном пространстве
222Глава 9. Теплоотдача при конденсации пара
2221. Сведения о механизме конденсации паров металлов
2252. Термическое сопротивление фазового перехода
2283. Термическое сопротивление пленки конденсата
2314. Теплоотдача при конденсации ртутного и натриевого пара
235Глава 10. Теплоотдача при кипении
2351. Основные сведения о кипении
2392. Теплоотдача при пузырьковом кипении жидких металлов в большом объеме и в трубах
257Глава 11. Стойкость конструкционных материалов в жидких металлах
257Механизм коррозионного воздействия жидких металлов на конструкционные материалы
257[Введение]
264Ртуть
271Натрий и калий
283Литий
284Висмут, свинец и сплав Pb—Bi
288Литература
297Оглавление
300Концевая страница
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: info@biblioatom.ru
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Ртуть. Описание, свойства, происхождение и применение металла
Ртуть — минерал, природная металлическая ртуть. Переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Иногда содержит примесь серебра и золота.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Иногда содержит примесь серебра и золота.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Сингония тригональная, гексагонально-скаленоэдрическая (ниже -39°С).
СВОЙСТВА
Цвет оловянно-белый. Блеск сильный металлический. Температура кипения 357 °C. Единственный жидкий минерал при обычной температуре. Затвердевает, приобретая кристаллическое состояние при −38°С. Плотность 13,55. На огне легко испаряется с образованием ядовитых паров. В древности вдыхание этих паров было единственным доступным средством лечения сифилиса (по принципу: если больной не умрёт, то поправится. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен) Украине (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом. Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
ПРОИСХОЖДЕНИЕ
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
ПРИМЕНЕНИЕ
Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как обладает довольно широким диапазоном, в котором находится в жидком состоянии, её коэффициент термического расширения почти не зависит от температуры и обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
Ртуть используется в датчиках положения.
Иодид ртути(I) используется как полупроводниковый детектор радиоактивного излучения.
Фульминат ртути(II) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
Бромид ртути(I) применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
До середины 20 века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба).
Соединения ртути использовались в шляпном производстве для выделки фетра.
Ртуть (англ. Mercury) – Hg
КЛАССИФИКАЦИЯ
ФИЗИЧЕСКИЕ СВОЙСТВА
ОПТИЧЕСКИЕ СВОЙСТВА
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
Интересные статьи:
Прекрасный и ужасный | Чудеса и Приключения
Древним алхимикам не давала покоя легенда, что когда-то удалось превратить ртуть в золото
Светлое тело
«Человек, знающий силу молитв, – пророк, а знающий силу ртути – Бог», – утверждает древнеиндийская мудрость. К сожалению, мы все ещё не боги, ибо тайна ртути до сих пор полностью не раскрыта, хотя этот удивительный металл известен человечеству почти четыре тысячи лет. Мы даже не можем ответить на вопрос: враг нам ртуть или друг?
К сожалению, мы все ещё не боги, ибо тайна ртути до сих пор полностью не раскрыта, хотя этот удивительный металл известен человечеству почти четыре тысячи лет. Мы даже не можем ответить на вопрос: враг нам ртуть или друг?
Перевод названия ртути с латинского argentum vivum буквален – живое серебро. Более удивительного металла на нашей планете нет. Этот жидкий металл, прекрасный и ужасный одновременно, полон поразительных свойств.
Он бежит быстрее, чем вода, но при этом почти в 14 раз плотнее воды – вы только представьте, тяжеленная чугунная гиря плавает в ртути легко, словно сухой листик! Как вода, ртуть способна замерзать при сильном морозе, но, в отличие от оной, настолько сильно, что её не может раздавить даже гидравлический пресс.
Ртуть – это очень «увесистый» металл. Один литр её имеет массу около 14 кг. Ведро, наполненное жидкой ртутью, весит 130 кг! А ещё ртуть хоть в жидком, хоть в твёрдом состоянии великолепно проводит электричество и тепло.
Ученые долгое время колебались, стоит ли причислять ртуть к металлам. С одной стороны, она очень на них похожа. В жидком состоянии обладает почти полным комплексом металлических свойств: тепло- и электропроводностью, металлическим блеском, а при охлаждении до минус 39 °С вообще становится, по образному выражению М.В. Ломоносова, одним из «светлых тел, которые ковать можно».
С одной стороны, она очень на них похожа. В жидком состоянии обладает почти полным комплексом металлических свойств: тепло- и электропроводностью, металлическим блеском, а при охлаждении до минус 39 °С вообще становится, по образному выражению М.В. Ломоносова, одним из «светлых тел, которые ковать можно».
Но с другой стороны, металл, столь похожий на воду, находящийся в жидком состоянии в условиях, которые мы называем нормальными? Даже Ломоносов долго колебался, не зная, куда причислить ртуть.
В конце концов, учёные пришли к выводу, что таинственная ртуть – всё-таки металл. Случилось это в 1759 году, когда выдающиеся учёные Михаил Ломоносов и Иосиф Браун смогли доказать этот факт. А Дмитрий Иванович Менделеев в своей таблице периодических элементов поместил ртуть рядом с золотом.
Итак, ртуть – металл. Очень своеобразный, но металл. И при этом очень ядовитый. Но об отравляющих свойствах ртутных паров человечество узнало не так уж давно.
Выпьем ртути, где же кружка?!
В древности у ртути была совершенно противоположная репутация: она считалась полезной, из неё делали множество различных снадобий и чудодейственных лекарственных средств. Она входила в состав мочегонных и слабительных препаратов, использовалась в стоматологии, при лечении кожных и венерических заболеваний. В Китае даже готовили особую «пилюлю бессмертия» на основе этого металла.
Она входила в состав мочегонных и слабительных препаратов, использовалась в стоматологии, при лечении кожных и венерических заболеваний. В Китае даже готовили особую «пилюлю бессмертия» на основе этого металла.
Марко Поло, описывая жизнь кугки, то есть йогов, говорит об их феноменальной продолжительности жизни, до 150–200 лет, и указывает, что секрет долголетия состоит в том, что кугки пьют специальный напиток, в состав которого входят ртуть и сера.
Похожие данные приводит и другой исследователь-путешественник, Франсуа Бернье, долгое время изучавший образ жизни индийских аскетов и йогов. Бернье писал, что большинство из этих людей знали рецепт приготовления особых снадобий из ртути. И что достаточно выпить всего лишь две капли этого эликсира рано утром, чтобы на протяжении дня все системы организма прекрасно работали, а человек чувствовал себя в отличной физической форме и добром здравии.
Стоит ли приходить в ужас от того, что люди в древности вкушали ртуть? На самом деле, ртуть в нашем организме присутствует, и её физиологический эффект определяется способностью вступать в обратимые реакции с функционально активными группами биомолекул (пептидов, белков). Ртуть содержится во всех органах и тканях нашего организма, а попадает она внутрь через лёгкие и желудочно-кишечный тракт. Пищевыми источниками ртути служат морская рыба и другие морепродукты, а также рис, морковь, салат-латук.
Ртуть содержится во всех органах и тканях нашего организма, а попадает она внутрь через лёгкие и желудочно-кишечный тракт. Пищевыми источниками ртути служат морская рыба и другие морепродукты, а также рис, морковь, салат-латук.
Разумеется, станет ли ртуть ядом, зависит, во-первых, от той химической формы, в которой она поступает в организм (как утверждают исследователи, ртуть в жидком виде при попадании в организм в целом нетоксична), а во-вторых, от её количества.
Содержание ртути в организме человека – 13 мг, суточная потребность человека в ней – 1–5 мкг. При недостаточном поступлении ртути в организм (0,5 мкг/день и менее) может развиться её дефицит. Порог токсичности ртути равняется 50 мкг. Летальная «ртутная» доза для человека составляет 150–300 мг.
Возможно, в чём-то древнеиндийские йоги были и правы: в наши дни доказано, что ртуть в терапевтических дозах необходима при воспалительных процессах, пониженном иммунитете, при опухолях, а о её недостатке свидетельствуют частые простудные заболевания, множественные воспалительные процессы. Так что и яд, как говорится, может быть лекарством.
Так что и яд, как говорится, может быть лекарством.
Магия ртути
Ртуть в древности была не только лечебной, но «противодемонической». Считалось, что она обладает магическими свойствами и особенно хорошо действует против духов и всяческих злых сущностей. Чтобы разогнать скопившуюся нечисть, ртуть, как правило, распыляли в воздухе, и всё кружащееся зло трусливо сбегало из «аномальной» зоны.
В Древнем Китае ртуть ассоциировалась с драконом, а также с жидкостями человеческого организма. В Древнем Египте жрецы использовали ртуть в различных тайных ритуалах и церемониях. Она даже отправлялась на тот свет вместе с почившим фараоном: в горло мумии жрецы вкладывали специальный флакон из дерева или гранита, в котором хранилось 3,5 г ртути и энное количество пойманных духов. Это делалось для того, чтобы фараон мог повелевать ими в загробном мире.
Марина Ситникова
Фотография — shutterstock.com ©
Продолжение читайте в августовском номере (№8, 2016) журнала «Чудеса и приключения», стр. 56-60
56-60
Похожие статьи:
40 интересных фактов о металлах
Большинство элементов в периодической таблице это металлы, плюс есть многочисленные сплавы, состоящие из смесей металлов. Итак, неплохо было бы узнать, что такое металлы и кое-что о них. Вот 40 интересных и полезных фактов об этих важных материалах:
Самый чистый металл — Германий
Германий, очищенный по технологии зонального синтеза с чистотой «тринадцать девять» (99,999999999%).
Самый распространенный металл – Алюминий
Около 8 процентов земной коры состоит из Алюминия. Соединения алюминия встречаются по всему миру. Обычная почва также содержит много алюминатов.
Хотите больше узнать про алюминий? Тогда мы советуем прочитать в нашем блоге статью: «Как обрабатывать алюминий: Все, что вам нужно знать!».
Трехводный боксит представляет собой минерал гидроксида алюминия и является основным компонентом в месторождении бокситов.
Самый редкий металл – Полоний
Очень небольшое количество в коре.
Самый легкий металл – Литий
В два раза меньше веса воды, он может плавать не только на воде, но и в керосине.
Первой найденной литиевой рудой был пертит.
Самый тугоплавкий металл — Вольфрам
Температура плавления составляет 3410 ℃, температура кипения — 5700 ℃. Вольфрам используется в лампах накаливания. При включенной лампе, температура накала нити выше 3000 ℃, только вольфрам может выдержать такую высокую температуру. Китай является крупнейшей в мире страной по хранению вольфрама, в основном шеелита и вольфрамита.
Шеелит
Металл с самой низкой температурой плавления — Ртуть
Киноварь является основным минеральным сырьем для рафинирования ртути. Кристалл может быть использован в качестве важного материала для лазерной технологии.
Самый производимый металл — железо
Железо является металлом с самым высоким годовым объемом производства. В 2017 году мировое производство нерафинированной стали достигло 1,6912 млрд тонн. Железо также является вторым по распространенности металлическим элементом в земной коре.
В 2017 году мировое производство нерафинированной стали достигло 1,6912 млрд тонн. Железо также является вторым по распространенности металлическим элементом в земной коре.
Гематит широко распространен в природе, является важным сырьем для получения железа, а также может использоваться в качестве красного пигмента.
Металл, который лучше всего поглощают газ — Палладий
Один объем металлического палладия при комнатной температуре может поглотить 900-2 800 объемов водорода.
Платино-палладиевый рудник
Самый податливый металл – Золото
1 грамм золота может быть вытянут в нить длиной 4000 метров; если сплющивать золото, то толщина может достигать 5x10e-4 мм.
Самый ковкий металл — Платина
Диаметр самой тонкой платиновой проволоки составляет всего 1/5000 мм.
Самородная платина
Самый проводящий металл — Серебро
Серебро в 59 раз более электропроводна, чем ртуть
Самородное серебро
Самые распространенный металл в организме человека — Кальций
Кальций является самым распространенным металлическим элементом в организме человека, составляя примерно 1,4% человеческого тела.
Основной состав доломита — CaMg(CO3)2
Переходный металл высшего класса — Скандий
Порошок скандия является легковоспламеняющимся веществом. Есть предположения, что скандий будет основой нового ракетного топлива, которое сможет обеспечить передвижение кораблей между планетами.
Самый дорогой металл – Калифорний
В 1975 году считалось, что в мире всего около грамма калифорния, а грамм стоил около 1 миллиарда долларов.
Самый простой в использовании сверхпроводящий элемент — Ниобий
Когда он охлаждается до температуры -263,9℃, он превращается в сверхпроводник, который практически не имеет сопротивления.
Pyrochlore. A mineral containing niobium
Самый тяжелый металл — Осмий
Иридий весит 22,59 грамма на кубический сантиметр, его плотность примерно в два раза выше свинца и в три раза выше железа.
Наименее твердый металл — Натрий
Натрий: имеет твердость по шкале Мооса 0,4 и может быть разрезан ножом при комнатной температуре.
Sodium chloride
Самый твердый металл — Хром
Хром (Cr), известный как «твердая кость», — это серебристо-белый металл, чрезвычайно твердый и хрупкий. По шкале Мооса — 9, уступает только алмазам.
Хромово-свинцовая руда является первым искусственным минералом, который был открыт.
Самый ранний из используемых металлов — Медь
Согласно исследованиям, история самых ранних бронзовых изделий Китая насчитывает более 4000 лет.
Chalcopyrite. Chinese Shang Dynasty already used chalcopyrite to refine copper
Металл с наибольшим количеством жидкости — Галлий
Его температура плавления составляет 29,78 ℃, температура кипения — 2205 ℃.
Галлий является побочным продуктом промышленной переработки сфалерита, пирита, бокситов и германия. На рисунке изображен чистый галлий.
Металл, который с наибольшей вероятностью создаст электрический ток при воздействии света — Цезий
Его основное применение — производство различных фотоэлементов.
Цезиевый цеолит, ранее известный как креманит
Самый активный элемент щелочноземельных металлов — Барий
Химическая активность бария очень велика, он является самым активным среди щелочноземельных металлов. Он был введен в качестве металлического элемента в 1808 году.
Наиболее распространенным минералом в природе является барит.
Металл, который больше всех боится холода — Олово
Когда температура ниже 13,2 ℃, олово начинает разрушаться; когда температура ниже -30 ~ -40 ℃, оно немедленно превращается в порошок, это явление часто называют «оловянной чумой».
«Оловянная чума»
Наиболее токсичный металл для человека – Плутоний
Он в 486 миллионов раз смертоноснее мышьяка и является самым мощным канцерогеном, а 1х10-6 граммов плутония способны вызвать рак.
Самый крупный самородок золота
Находка была сделана 19 октября 1872 года на золотом руднике «Звезда надежды» в районе Хиллендер в Австралии, вес находки 214,3 килограмма.
Самое большое природное золото было сфотографировано вместе с его первооткрывателем в 1872 году.
Самое крупное натуральное серебро
Найденный в мексиканском регионе Сонора, самородок из натурального серебра весил 1026,5 килограмма.
Самородное серебро
Крупнейший самородок меди
Весом 26 тонн, он был обнаружен в 1977 году на шахте Хортон Куинси в американском штате Мичиган.
Самые большие запасы радиоактивных элементов в море — Уран
Уран — самый распространенный радиоактивный элемент в морской воде, его количество оценивается в 4 миллиарда тонн, что в 1544 раза больше, чем на суше.
Урановая руда
Самые распространенные элементы в морской воде — калий
Калий присутствует в морской воде в виде ионов калия, его содержание составляет около 0,38 г/кг, это элемент с самым высоким содержанием в морской воде.
Нитрат может быть непосредственно произведен путем добычи и обогащения
Металл с наибольшим атомным номером среди стабильных элементов — свинец
Свинец имеет самый высокий атомный номер среди всех стабильных химических элементов. В природе существует четыре стабильных изотопа: свинец 204, 206, 207 и 208.
В природе существует четыре стабильных изотопа: свинец 204, 206, 207 и 208.
Свинцовая руда
Самый распространенный аллергенный металл для человека — Никель
Никель является наиболее распространенным сенсибилизирующим металлом, и около 20 процентов людей имеют аллергию на ионы никеля.
Nickel mine, also known as “red nickel mine”
Самый важный металл в аэрокосмической промышленности — Титан
Титан — это серый переходный металл, характеризующийся легкостью, высокой прочностью и хорошей коррозионной стойкостью, который называют «космическим металлом».
Титановая руда
Самый кислотный металл — Тантал
Как в холодных, так и в жарких условиях он не вступает в реакцию с соляной кислотой, концентрированной азотной кислотой и “хлороазотической кислотой”. Даже при помещении в концентрированную серную кислоту при температуре 175 ℃ в течение года толщина коррозии составляет всего 0,0004 мм.
Танталовая руда
Металл с наименьшим атомным радиусом — Бериллий
Его атомный радиус составляет 89pm
Самый коррозионностойкий металл — Иридий
Иридиевая кислота очень химически стабильна, нерастворима в кислотах, и только губчатый иридий медленно растворяется в горячей водной среде. Если он находится в компактном состоянии, то даже кипящая водная вытяжка не может его разъесть.
Если он находится в компактном состоянии, то даже кипящая водная вытяжка не может его разъесть.
Иридий естественным образом присутствует в платиновом руднике
Самый отличительный по цвету металл — Медь
Чистая металлическая медь окрашена в розовато-лиловый цвет.
Медный порошок
Металл с наибольшим количеством изотопов — Олово
Существует 10 стабильных изотопов.
Самый тяжелый щелочной металл — Франций
Образуется при распаде актинидов, является радиоактивным металлом. Это самый тяжелый металл в ряду щелочных металлов. Атомная масса — 223.
Последний металл, найденный человеком — Рений
Суперметалл рений — действительно редкий элемент, к тому же он не образует фиксированных минералов, обычно связанных с другими металлами. Это делает его последним элементом, найденным в природе.
Металл Рений содержится в молибдене
Самые особенный металл при комнатной температуре — Ртуть
При комнатной температуре металлы обычно находятся в твердом состоянии, но ртуть является самым необычным металлом, и единственная находится в жидком состоянии при комнатной температуре.
Жидкая ртуть, также известная как «меркурий»
Может ли ртуть находиться в твердом состоянии?
Ртуть является одновременно жидкостью при комнатной температуре (поскольку имеет очень низкую температуру плавления -39°C) и металлом . Мы склонны считать, что все металлы являются твердыми телами, но это не так.
Может ли ртуть быть твердым телом? Ртуть может быть твердым телом. Хотя ртуть является единственным распространенным металлом, находящимся в жидком состоянии при комнатной температуре, она может замерзнуть и стать твердой при температуре -38,72 градуса Цельсия .
Почему ртуть не твердая?
Ртуть имеет уникальную электронную конфигурацию, которая сильно сопротивляется удалению электрона, что делает ее поведение похожим на элементы благородных газов. В результате ртуть образует слабые связи и при комнатной температуре является жидкостью.
В результате ртуть образует слабые связи и при комнатной температуре является жидкостью.
При какой температуре ртуть переходит в твердое состояние?
Удивительно, но почти каждый элемент может существовать в твердом, жидком и газообразном состояниях — все зависит от температуры. Ртуть, например, обычно находится в жидком состоянии, но при температуре -40 градусов по Цельсию она замерзает и превращается в твердое тело. 12 декабря 2012 г.
Можно ли купить жидкую ртуть?
Законно покупать жидкую ртуть в сыром виде примерно в любом месте в магазинах химических материалов и у специализированных продавцов, таких как Luciteria Science!
Что произойдет, если ртуть коснется золота?
Фредди Меркьюри, возможно, и обладал золотым голосом, но настоящая ртуть, этот бесконечно интересный и опасный жидкий металл, обладает золотым оттенком. То есть, если он коснется золота , он немедленно разорвет связи в решетке драгоценного металла и образует сплав в процессе , известном как амальгамация. 18 ноября 2017 г.
То есть, если он коснется золота , он немедленно разорвет связи в решетке драгоценного металла и образует сплав в процессе , известном как амальгамация. 18 ноября 2017 г.
Связанные
Можно ли прикасаться к ртути?
Ртуть является очень токсичным или ядовитым веществом, воздействию которого люди могут подвергаться несколькими способами. Если его проглотить, например, из разбитого термометра, он в основном проходит через ваше тело и очень мало всасывается. Если вы дотронетесь до него, небольшое количество может пройти через вашу кожу , но обычно недостаточно, чтобы причинить вам вред.
Связанные
Как ртуть встречается в природе?
Ртуть редко встречается в природе в виде чистого жидкого металла , но чаще встречается в виде соединений и неорганических солей. … Ртуть добывается в виде сульфида ртути (киноварь). На протяжении всей истории залежи киновари были исходными рудами для коммерческой добычи металлической ртути.
… Ртуть добывается в виде сульфида ртути (киноварь). На протяжении всей истории залежи киновари были исходными рудами для коммерческой добычи металлической ртути.
Связанные
Затвердевает ли ртуть?
Согласно современной химии, вы не можете затвердеть ртуть при комнатной температуре; вы можете затвердеть ртуть, только если вы доведете ее до -38 градусов по Цельсию. … Но теперь при комнатной температуре ртуть затвердевает без каких-либо добавок .
Связанные
Что представляет собой ртуть в жидком или твердом состоянии?
Элементарная (металлическая) ртуть
Элементарная или металлическая ртуть представляет собой блестящий серебристо-белый металл, исторически называемый ртутью, и является жидкостью при комнатной температуре .24 сентября 2021 г.
Почему ртуть считается металлом?
Ртуть также иногда называют ртутью или жидким серебром. … Ртуть классифицируется как «переходный металл» как , она пластична, податлива и способна проводить тепло и электричество .
… Ртуть классифицируется как «переходный металл» как , она пластична, податлива и способна проводить тепло и электричество .
Связанные
Что будет, если заморозить ртуть?
В 1911 году голландский физик Хайке Камерлинг-Оннес открыл явление сверхпроводимости , заморозив ртуть всего на несколько градусов выше абсолютного нуля. При такой температуре ртуть теряет все свое естественное сопротивление потоку электричества и становится сверхпроводящей.
Связанные
Является ли ртуть магнитной?
Это единственная каменистая планета с глобальным магнитным полем , как у Земли . … Измерения, сделанные «Маринер-10» в 1974/75 году, показали, что у Меркурия тоже есть магнитное поле. Согласно стандартным моделям, динамо-эффект в его металлическом ядре должен генерировать напряженность поля, аналогичную земной. 22 декабря 2011 г.
22 декабря 2011 г.
Родственный
Может ли золото превратиться в газ?
Любой элемент может стать газом; вам просто нужно нагреть его до температуры кипения . Для золота это 2856 градусов по Цельсию (5173 градуса по Фаренгейту), что выше, чем температура в дуговой печи, поэтому трудно просто вскипятить слиток золота. 30 июля 2012 г.
Какая польза от твердой ртути?
Mercury — хорошо известный металл , который обычно используется в термометрах и барометрах. Меркурий необычен, так как он является жидкостью при комнатной температуре, в то время как большинство других металлов являются твердыми . Есть два способа отверждения ртути , и они включают либо изменение внешней температуры, либо изменение внешнего давления.
Родственные
Почему ртуть считается металлом?
Ртуть — единственный металл , который является жидким при стандартной температуре и давлении: на самом деле это металл , который может оставаться жидким в самом широком диапазоне условий.
 Это в основном связано с ненормальным поведением электронов, вращающихся вокруг атома, и делает его одним из пяти элементов, которые в нормальном состоянии находятся в жидком состоянии.
Это в основном связано с ненормальным поведением электронов, вращающихся вокруг атома, и делает его одним из пяти элементов, которые в нормальном состоянии находятся в жидком состоянии.
Родственный
Является ли элемент ртуть твердым или газообразным?
Несмотря на то, что ртуть является единственным металлом, который находится в жидком состоянии при комнатной температуре, у ртути самый маленький диапазон жидкого состояния среди всех металлов. Он становится твердым при -38,83°C и газом при 356,7°C. Некоторые рыбы, такие как рыба-меч и акула, могут содержать большое количество ртути.
Родственные
Ртуть твердое или жидкое?
Mercury представляет собой жидкость при КОМНАТНОЙ ТЕМПЕРАТУРЕ. Это важное отличие, и причина, по которой Mercury так знаменита.
 Все атомы могут стать твердыми , жидкими , газом или плазмой, и это просто вопрос свойств и температуры атома, находится ли он в любом из этих состояний.
Все атомы могут стать твердыми , жидкими , газом или плазмой, и это просто вопрос свойств и температуры атома, находится ли он в любом из этих состояний.
Родственный
Ртуть твердое или жидкое? Ртуть твердое или жидкое?
Ртуть может быть твердой. Хотя ртуть является единственным распространенным металлом, находящимся в жидком состоянии при комнатной температуре, она может замерзнуть и стать твердой при температуре -38,72 градуса Цельсия.
Связанные
Что такое затвердевание ртути? Что такое затвердевание ртути?
Затвердевающая ртуть. Элемент ртути является жидкостью при комнатной температуре из-за слабых атомных связей. Температура плавления ртути составляет -38,83 градуса по Цельсию или -37,89 градуса по Фаренгейту. Ртуть можно затвердеть, охладив ее ниже точки плавления. Другой метод затвердевания ртути заключается в воздействии на нее высокого давления выше 14 килобар.
Другой метод затвердевания ртути заключается в воздействии на нее высокого давления выше 14 килобар.
Связанные
Ртуть металл или неметалл? Ртуть металл или неметалл?
Ртуть – это металл, который находится в жидком состоянии при комнатной температуре. Некоторые элементы в периодической таблице названы «металлами» не из-за состояния, в котором они появляются при комнатной температуре, а из-за их зонной модели.
Связанные
Каковы характеристики и свойства ртути? Каковы характеристики и свойства ртути?
Характеристики и свойства. При стандартных условиях ртуть представляет собой блестящую, тяжелую, серебристую жидкость. Это единственный металл, который находится в жидком состоянии при комнатной температуре. Он испаряется в воздух при комнатной температуре.
общий Информация СМИ Нажмите галерея иллюстрация
Поделиться этой записью:
Ртуть переходит в твердое состояние при комнатной температуре в наномасштабе и потенциальное хранилище ртутных отходов
Ртуть переходит в твердое состояние при комнатной температуре в наномасштабе и потенциальное хранилище ртутных отходов
Скачать PDF
Скачать PDF
- Артикул
- Открытый доступ
- Опубликовано:
- Н. Кана 1,2 ,
- Р. Морад 1,2 ,
- М. Акбари 1,2 ,
- M. Henini 1,2,3 ,
- J. Niemela 4 ,
- F. Hacque 1,2,5 , 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444
- . ,6 и
- …
- М. Мааза 1,2
Научные отчеты том 12 , Номер статьи: 3494 (2022) Процитировать эту статью
1490 доступов
15 Альтметрический
Сведения о показателях
Предметы
- Материаловедение
- Нанонаука и технологии
- Физика
Abstract
Несмотря на то, что объемная ртуть при комнатной температуре является жидкой, в своей наноконфигурации она является твердой (Ø нано-Hg ≤ 2,5 нм). Сопрягая наноразмерный эффект и избыточное поверхностное давление, обусловленное Лапласом, наночастицы Hg Ø нано-Hg ≤ 2,4 нм, внедренные в двумерную турбостратную матрицу-основу из нитрида бора (BN), продемонстрировали чистую кристаллизацию при комнатной температуре через экспериментально наблюдаемые (101) и (003) дифракционные брэгговские пики твердой ромбоэдрической α-фазы Hg. Наблюдаемая кристаллизация коррелирует с упорядочением атомов на поверхности от 7 до 8 сетчатых атомных планов ромбоэдрической α-фазы. Такая новизна влияния размера на явления фазового перехода в Hg сопряжена с потенциальной технологией хранения ртутных отходов. Учитывая давление паров объемной ртути, комнатная температура (КТ) Удержание твердой нано-ртути может представлять собой потенциальный экологически чистый подход к хранению ртутных отходов, основанный на современной технологии эффективного освещения с использованием галогенов.
Сопрягая наноразмерный эффект и избыточное поверхностное давление, обусловленное Лапласом, наночастицы Hg Ø нано-Hg ≤ 2,4 нм, внедренные в двумерную турбостратную матрицу-основу из нитрида бора (BN), продемонстрировали чистую кристаллизацию при комнатной температуре через экспериментально наблюдаемые (101) и (003) дифракционные брэгговские пики твердой ромбоэдрической α-фазы Hg. Наблюдаемая кристаллизация коррелирует с упорядочением атомов на поверхности от 7 до 8 сетчатых атомных планов ромбоэдрической α-фазы. Такая новизна влияния размера на явления фазового перехода в Hg сопряжена с потенциальной технологией хранения ртутных отходов. Учитывая давление паров объемной ртути, комнатная температура (КТ) Удержание твердой нано-ртути может представлять собой потенциальный экологически чистый подход к хранению ртутных отходов, основанный на современной технологии эффективного освещения с использованием галогенов.
Введение
Ртуть (Hg) является одним из, если не самым своеобразным, периодическим элементом, если учесть его нетипичные физико-химические свойства при комнатной температуре. Меркурий стоял у истоков экспериментального открытия явления сверхпроводимости в 1911 году Камерлинг-Оннесом. В физике высоких энергий; его повышенная плотность уменьшает физическую длину мишени и влияет на конструкцию системы захвата пионов, временной разброс результирующего -всплеска, а также на рождение пионов, как было подтверждено ЦЕРН и Брукхейвенской национальной лабораторией с использованием протонного пучка 24 ГэВ (150 нс). В астрономии, а также в связи с его жидкометаллическим состоянием и, следовательно, его низкой шероховатостью поверхности в сочетании с его высокой отражательной способностью в инфракрасном диапазоне, он использовался в качестве эффективного большого жидкого ИК-зеркала, что подтверждено подразделением, созданным в обсерватории Нью-Мексико. Точно так же его высокие оптические характеристики, отражающие инфракрасное излучение, сделали его жизнеспособным зеркалом со скользящим падением для экспериментов с лазерной инерционной термоядерной энергией, что подтверждено Ливерморской национальной лабораторией Лоуренса.
Меркурий стоял у истоков экспериментального открытия явления сверхпроводимости в 1911 году Камерлинг-Оннесом. В физике высоких энергий; его повышенная плотность уменьшает физическую длину мишени и влияет на конструкцию системы захвата пионов, временной разброс результирующего -всплеска, а также на рождение пионов, как было подтверждено ЦЕРН и Брукхейвенской национальной лабораторией с использованием протонного пучка 24 ГэВ (150 нс). В астрономии, а также в связи с его жидкометаллическим состоянием и, следовательно, его низкой шероховатостью поверхности в сочетании с его высокой отражательной способностью в инфракрасном диапазоне, он использовался в качестве эффективного большого жидкого ИК-зеркала, что подтверждено подразделением, созданным в обсерватории Нью-Мексико. Точно так же его высокие оптические характеристики, отражающие инфракрасное излучение, сделали его жизнеспособным зеркалом со скользящим падением для экспериментов с лазерной инерционной термоядерной энергией, что подтверждено Ливерморской национальной лабораторией Лоуренса.
Hg — уникальный металл, не образующий двухатомных молекул в газовой фазе. Его объемное свойство жидкости при комнатной температуре коррелирует с его конфигурацией, подобной инертному газу (Xe) 6s 2 4f 14 d 10 . Точнее, к релятивистскому сжатию, вызванному дираковской динамикой валентных электронов 1 . В результате релятивистского увеличения массы m = m 0 /√(1 − (v/c)), “v/c ~ 0,58”, радиальное уменьшение эффективного боровского радиуса r 0 = (ε 0 h/m e e 2 ) внутренних «1s» электронов, is ~ 23% 1 . Поскольку электронные оболочки высокого порядка «s» должны быть ортогональны по отношению к более низким, они будут подвергаться релятивистскому сжатию аналогичного радиуса, вызывая слабое кулоновское взаимодействие между соседними атомными позициями Hg.
Hg как отдельный жидкий металл в объемной форме имеет самое высокое поверхностное натяжение элемента при комнатной температуре; ~ 486 мН/м 2 . Теоретические расчеты на границе раздела жидкость–пар простых металлов в целом 3,4 и методы, основанные на модели гелиума, в частности 5 , и разложение возмущения до второго порядка по поверхностному «е-ионному» псевдопотенциалу 6,7 , показали, что избыточное поверхностное натяжение может стимулировать значительное поверхностное атомное расслоение из 3–5 атомных плоскостей, как показано на рис. 1a, и соответствующий периодический профиль плотности электронов от поверхности к объему. Это упорядочение атомов на поверхности, в полном согласии с теорией капиллярных волн, наблюдалось при измерениях отражательной способности рентгеновских лучей на объемной поверхности жидкой ртути Pershan et al. 8 . Аналогичным образом Bafile et al. 9,10 показали, что такое упорядочение атомов можно выделить в объеме жидкой ртути, исследуя высоту и ширину в дополнение к положению основных пиков статического структурного фактора S(Q) в условиях окружающей среды.
Теоретические расчеты на границе раздела жидкость–пар простых металлов в целом 3,4 и методы, основанные на модели гелиума, в частности 5 , и разложение возмущения до второго порядка по поверхностному «е-ионному» псевдопотенциалу 6,7 , показали, что избыточное поверхностное натяжение может стимулировать значительное поверхностное атомное расслоение из 3–5 атомных плоскостей, как показано на рис. 1a, и соответствующий периодический профиль плотности электронов от поверхности к объему. Это упорядочение атомов на поверхности, в полном согласии с теорией капиллярных волн, наблюдалось при измерениях отражательной способности рентгеновских лучей на объемной поверхности жидкой ртути Pershan et al. 8 . Аналогичным образом Bafile et al. 9,10 показали, что такое упорядочение атомов можно выделить в объеме жидкой ртути, исследуя высоту и ширину в дополнение к положению основных пиков статического структурного фактора S(Q) в условиях окружающей среды. Как рентгеновские, так и нейтронографические профили S(Q) выявили структуру до 4–5 различимых пиков: признак локального поверхностного упорядочения атомов 10 .
Как рентгеновские, так и нейтронографические профили S(Q) выявили структуру до 4–5 различимых пиков: признак локального поверхностного упорядочения атомов 10 .
( a ) Теоретическое поверхностное упорядочение атомов в жидкой ртути с соответствующим изменением электронной плотности по глубине, ( b ) Схематическое изображение анизотропии формы объема и поверхности в каплях Hg, ( c ) Диаграмма состояния Hg (согласно 11 ), ( d ) Схематическое изображение наночастиц Hg, заключенных в химически инертном турбостратном BN Матрица хозяина.
Изображение в натуральную величину
Такое упорядочение атомов на поверхности RT, наблюдаемое на плоской поверхности объемной ртути, может быть значительно, если не радикально, улучшено на наночастицах Hg, если бы их можно было сконструировать. В самом деле, в результате их значительного соотношения поверхность/объем и нарушения трехмерной симметрии популяция поверхностных атомов будет больше в наноразмерной ртути. Отныне в таком масштабе поверхностные явления преобладают над гравитационными эффектами ввиду значительно повышенного поверхностного натяжения ртути (рис. 1б). Улучшенное отношение поверхности наноразмерной ртути радиусом «Ø нано-рт.ст. /2” должен вызывать превышение поверхностного давления по Лапласу ∆P 4/Ø нано-рт.ст. в десятки МПа. В качестве оценки, если Ø нанорт.ст. 2,50 нм, ∆P 0,76 ГПа при комнатной температуре. Учитывая фазовую диаграмму ртути на рис. 1c, такое избыточное поверхностное давление при КТ должно вызывать чистую кристаллизацию из пространства ликвидуса в твердую а-ромбоэдрическую фазу 11 нано-Hg (рис. 1c). Следовательно, это явление упорядочения атомов при КТ должно проявляться через значительную кристаллизацию из жидкой фазы в твердую ромбоэдрическую фазу «-типа».
Отныне в таком масштабе поверхностные явления преобладают над гравитационными эффектами ввиду значительно повышенного поверхностного натяжения ртути (рис. 1б). Улучшенное отношение поверхности наноразмерной ртути радиусом «Ø нано-рт.ст. /2” должен вызывать превышение поверхностного давления по Лапласу ∆P 4/Ø нано-рт.ст. в десятки МПа. В качестве оценки, если Ø нанорт.ст. 2,50 нм, ∆P 0,76 ГПа при комнатной температуре. Учитывая фазовую диаграмму ртути на рис. 1c, такое избыточное поверхностное давление при КТ должно вызывать чистую кристаллизацию из пространства ликвидуса в твердую а-ромбоэдрическую фазу 11 нано-Hg (рис. 1c). Следовательно, это явление упорядочения атомов при КТ должно проявляться через значительную кристаллизацию из жидкой фазы в твердую ромбоэдрическую фазу «-типа».
Следовательно, оригинальность этого вклада заключается в подтверждении затвердевания наночастиц Hg при комнатной температуре, если их диаметр меньше критического значения Ø нано-Hg 2,50 нм. Более того, при таком пороговом условии Hg должна проявлять атомное упорядочение при комнатной температуре в соответствии с а-ромбоэдрической твердой фазой.
Более того, при таком пороговом условии Hg должна проявлять атомное упорядочение при комнатной температуре в соответствии с а-ромбоэдрической твердой фазой.
Эксперименты, экспериментальные результаты и обсуждение
Синтез сверхмалых изолированных наночастиц ртути ниже порога Ø
нано-Hg 2,5 нм Помимо аспекта безопасности, синтез нано-Hg сам по себе был крайне сложной задачей. В качестве прекурсора использовали ртуть(II) ацетат Hg (C 2 H 3 O 2 ) 2 . Тем не менее, основной дополнительной сложностью остается хранение нано-Hg отдельно друг от друга, в противном случае агломерация частиц нано-Hg, вызванная созреванием Ван-дер-Ваальса/Отсвальда, будет генерировать более крупные капли Hg и, следовательно, меньшее превышение поверхностного давления, чем требуемый порог кристаллизации. значение 0,76 ГПа при комнатной температуре. Как схематично показано на рис. 1d, для предотвращения процесса коалесценции нано-ртути после образования использовалась изолирующая основная матрица из двумерного нитрида бора «BN». Преднамеренный выбор такой матрицы-хозяина обусловлен ее химической инертностью по отношению к Hg и ее превосходной механической прочностью в дополнение к ее двумерной структуре.
Преднамеренный выбор такой матрицы-хозяина обусловлен ее химической инертностью по отношению к Hg и ее превосходной механической прочностью в дополнение к ее двумерной структуре.
Идеальными прекурсорами для получения матрицы BN были ортоборная кислота «H 3 BO 3 » и мочевина «H 2 NCONH 2 », а ацетат ртути «Hg (C 2 H 3 Hg O 2 ) 2 ” в качестве оптимального прекурсора ртути. Происходит следующая химическая реакция:
$$ {\text{2H}}_{{3}} {\text{BO}}_{{{3} }} + {\text{1H}}_{{ 2}} {\ text{NCONH}}_{{2}} + \xi {\text{Hg}}\left({{\text{C}}_{{2}} {\text{H}} _{{3}} {\text{O}}_{{2}} } \right)_{{2}} \to \xi {\text{Hg}} + {\text{2BN}} + \ , \# {\text{Газы}} $$
While the H 3 BO 3 and H 2 NCONH 2 initial compositions were kept stoichiometric, the Hg (C 2 H 3 O 2 ) 2 was varied so to получить наночастицы Hg в конечной матрице-хозяине BN. Относительная молярная исходная концентрация Hg (C 2 H 3 O 2 ) 2 по отношению к матрице BN соответственно варьировалась. Чем меньше эта молярная концентрация, тем меньше будет размер нанортути. Различные растворы H 3 BO 3 , H 2 NCONH 2 и HG (C 2 H 3 O 2 ) 2 , с M -Mor.traction из 2 ) 2 , с M -Mor.traction из 2 ) 2 , с M — 2 ). варьировали от 1, 1/4 и 1/20 для Hg (C 2 H 3 O 2 ) 2 в деионизированном H 2 O. Соответствующие образцы маркируются как: Hg 1/1 -BN, Hg 1/4 -BN, Hg 1/20 -BN. Отныне наночастицы Hg, если таковые имеются, будут иметь меньший размер в случае Hg 9.0323 1/20 -БН. Следовательно, основное внимание будет сосредоточено на этом образце Hg 1/20 -BN.
Относительная молярная исходная концентрация Hg (C 2 H 3 O 2 ) 2 по отношению к матрице BN соответственно варьировалась. Чем меньше эта молярная концентрация, тем меньше будет размер нанортути. Различные растворы H 3 BO 3 , H 2 NCONH 2 и HG (C 2 H 3 O 2 ) 2 , с M -Mor.traction из 2 ) 2 , с M -Mor.traction из 2 ) 2 , с M — 2 ). варьировали от 1, 1/4 и 1/20 для Hg (C 2 H 3 O 2 ) 2 в деионизированном H 2 O. Соответствующие образцы маркируются как: Hg 1/1 -BN, Hg 1/4 -BN, Hg 1/20 -BN. Отныне наночастицы Hg, если таковые имеются, будут иметь меньший размер в случае Hg 9.0323 1/20 -БН. Следовательно, основное внимание будет сосредоточено на этом образце Hg 1/20 -BN.
Исследования морфологии и пропускания электронов
На рисунке 2a представлены результаты трансмиссионной электронной микроскопии (ПЭМ) нанокомпозита Hg 1/20 -BN. Напряжение/время воздействия были значительно сокращены (≪ 20 с), чтобы свести к минимуму агломерацию наночастиц Hg. Наблюдаемое явление быстрой коалесценции во время наблюдений с помощью трансмиссионной электронной микроскопии присуще изолирующему состоянию неперколированных нанокомпозитов Hg-BN из-за отсутствия разряда электронов и рассеивания тепла, вызванного зондирующим электронным пучком. Исключая ртуть 9Образец 0323 1/1 -BN, нанокомпозиты Hg 1/4 -BN и Hg 1/20 -BN состояли из наноразмерных изолированных частиц Hg, внедренных в матрицу-хозяин BN. Их средний диаметр 〈Ø нано-Hg 〉 на ранней стадии электронно-лучевого воздействия оценивался в 3,8 и 2,4 нм в образцах Hg 1/4 -BN и Hg 1/20 -BN соответственно, в то время как Hg 1/1 -BN состоял из относительно крупных частиц Hg; в субмикронном диапазоне. После тепла, генерируемого электронным пучком ПЭМ, в первую очередь хорошо диспергированная нано-Hg в Hg 9Нанокомпозиты 0323 1/4 —BN и Hg 1/20 –BN начали быстро коалесцировать при воздействии на них пучка электронной микроскопии, даже если этот последний поддерживался при минимально возможном напряжении и времени воздействия 14 с.
Напряжение/время воздействия были значительно сокращены (≪ 20 с), чтобы свести к минимуму агломерацию наночастиц Hg. Наблюдаемое явление быстрой коалесценции во время наблюдений с помощью трансмиссионной электронной микроскопии присуще изолирующему состоянию неперколированных нанокомпозитов Hg-BN из-за отсутствия разряда электронов и рассеивания тепла, вызванного зондирующим электронным пучком. Исключая ртуть 9Образец 0323 1/1 -BN, нанокомпозиты Hg 1/4 -BN и Hg 1/20 -BN состояли из наноразмерных изолированных частиц Hg, внедренных в матрицу-хозяин BN. Их средний диаметр 〈Ø нано-Hg 〉 на ранней стадии электронно-лучевого воздействия оценивался в 3,8 и 2,4 нм в образцах Hg 1/4 -BN и Hg 1/20 -BN соответственно, в то время как Hg 1/1 -BN состоял из относительно крупных частиц Hg; в субмикронном диапазоне. После тепла, генерируемого электронным пучком ПЭМ, в первую очередь хорошо диспергированная нано-Hg в Hg 9Нанокомпозиты 0323 1/4 —BN и Hg 1/20 –BN начали быстро коалесцировать при воздействии на них пучка электронной микроскопии, даже если этот последний поддерживался при минимально возможном напряжении и времени воздействия 14 с. Картина ПЭМ на рис. 2а соответствует такому конечному морфологическому состоянию Hg 1/20 -BN после короткой экспозиции (~ 14 с). На рис. 2b показано несколько большее увеличение, но сверхкороткое время экспозиции образца Hg 1/20 -BN. Если наночастицы ртути имеют почти квазисферическую форму с существенно усеченными границами раздела, размер полидисперсности сразу же возрастает вслед за немного более высокой интенсивностью электронного пучка. Новый кажущийся диаметр наночастиц ртути колеблется от 1,5 до 28,9 мм.нм для образца Hg 1/20 -BN. Также наблюдается несколько более крупных искаженных наночастиц Hg диаметром ~ 63–70 нм. Это может совпадать с зонами образца, которые подвергались значительному нагреву от зондирующего электронного луча. Как показано на рис. 2b, стоит отметить, что четкие границы раздела наблюдаются как между интерфейсами Hg-BN, так и между интерфейсами Hg-Hg.
Картина ПЭМ на рис. 2а соответствует такому конечному морфологическому состоянию Hg 1/20 -BN после короткой экспозиции (~ 14 с). На рис. 2b показано несколько большее увеличение, но сверхкороткое время экспозиции образца Hg 1/20 -BN. Если наночастицы ртути имеют почти квазисферическую форму с существенно усеченными границами раздела, размер полидисперсности сразу же возрастает вслед за немного более высокой интенсивностью электронного пучка. Новый кажущийся диаметр наночастиц ртути колеблется от 1,5 до 28,9 мм.нм для образца Hg 1/20 -BN. Также наблюдается несколько более крупных искаженных наночастиц Hg диаметром ~ 63–70 нм. Это может совпадать с зонами образца, которые подвергались значительному нагреву от зондирующего электронного луча. Как показано на рис. 2b, стоит отметить, что четкие границы раздела наблюдаются как между интерфейсами Hg-BN, так и между интерфейсами Hg-Hg.
( a ) Низкое и ( b ) Высокое увеличение Просвечивающая электронная микроскопия Hg 1/20 -BN нанокомпозит со средним размером наночастиц Hg на ранней стадии 〈Ø Hg 〉 TEM ~ 2,4 нм, диспергированных в турбостратной матрице BN нанокомпозита Hg 1/20 .
Изображение полного размера
Кристаллографические исследования и исследования фазовых переходов
После этого нанокомпозиты Hg 1/ξ -BN были исследованы методом XRD. Особое внимание было уделено нанокомпозиту Hg 1/20 -BN, так как средний размер соответствующего нано-Hg при ТЭМ составлял 〈Ø Hg 〉 TEM ~ 2,4 нм. Эти последние заключенные нано-Hg имеют достаточно малый размер, чтобы подвергаться превышению поверхностного давления над пороговым значением 0,76 ГПа и, следовательно, будут иметь дифракционную особенность.
На рис. 3 показаны профили XRD при комнатной температуре для Hg 1/1 -BN (a), Hg 1/4 -BN (b) и Hg 1/20 -BN (c) и жидкого азота. (~ 78 K) дифракционная картина этого последнего (d), т.е. Hg 1/20 -BN при ~ 78 K. Как показано на рис. 3a, исключая (121) пик Брэгга основной матрицы BN-t, самая высокая Hg образец концентрации, т.е. Hg 1/1 -BN не имеет структуры пика Брэгга, присущей ртути, а представляет собой широкую аморфную выпуклость и очень широкий пик, простирающийся более чем на 10° (40°–50°). Это признаки аморфной жидкости без дальнего или среднего кристаллического порядка 12 .
Это признаки аморфной жидкости без дальнего или среднего кристаллического порядка 12 .
Профили дифракции рентгеновских лучей трех различных образцов при комнатной температуре; ( a ) Hg 1/1 -BN, ( b ) Hg 1/4 -BN, ( c ) Hg 1/20 -BN и ( d ) температурная дифрактограмма азота этого последнего образца «Hg 1/20 -BN нанокомпозита при ~ 78 К.
Полноразмерное изображение
самая низкая концентрация Hg, т. е. Hg 1/4 -BN. Он демонстрирует 3 узких дифракционных пика, относящихся к основной матрице BN-t (410), (132) и (203) пики Брэгга «карта ASTM 18-0251» (34). Кроме того, имеется интенсивный, но широкий пик Брэгга с центром при 2Θ ~ 32,72°. Этот пик с шириной на полувысоте ∆Θ ~ 6,3·10 –2 рад, может быть отнесена только к кристаллизованной ртути; точнее, к ромбоэдрической (101) ретикулярной ориентации «карты ASTM 09-0253» (35). По сравнению с дифракционной картиной Hg 1/1 -BN, хотя и широкий, такой брэгговский пик можно рассматривать как признак предварительного атомного упорядочения, демонстрируемого главным образом поверхностными атомами ртути внутри неперколяционной заключенной нано-Hg. Используя приближение Шеррера для этого широкого брэгговского пика Hg (101), средний размер соответствующих наночастиц Hg составляет 〈Ø нано-Hg 〉 S ~ 2,4 нм. Вероятно, такое атомоподобное упорядочение будет происходить от поверхностных атомов популяции нано-Hg и атомов меньшего диаметра согласно фазовой диаграмме рис. 1c.
По сравнению с дифракционной картиной Hg 1/1 -BN, хотя и широкий, такой брэгговский пик можно рассматривать как признак предварительного атомного упорядочения, демонстрируемого главным образом поверхностными атомами ртути внутри неперколяционной заключенной нано-Hg. Используя приближение Шеррера для этого широкого брэгговского пика Hg (101), средний размер соответствующих наночастиц Hg составляет 〈Ø нано-Hg 〉 S ~ 2,4 нм. Вероятно, такое атомоподобное упорядочение будет происходить от поверхностных атомов популяции нано-Hg и атомов меньшего диаметра согласно фазовой диаграмме рис. 1c.
Чтобы окончательно подтвердить существование пика Брэгга Hg (101) с поверхностным атомным наслоением, нанокомпозит Hg 1/20 -BN был тщательно исследован как при 293,5 (рис. 3c), так и при 78 K (рис. 3d). . Поскольку это образец с наименьшей объемной концентрацией ртути, соответствующая нано-Hg со средним диаметром 〈Ø нано-Hg 〉 TEM ~ 2,4 нм в соответствии с измерениями TEM будет демонстрировать наибольшее отношение поверхность/объем. Относительная интенсивность ртути (101) должна быть выше при той же объемной концентрации ртути. Как показано на рис. 3c, не только относительная интенсивность пика Брэгга Hg (101), относительно большая для нанокомпозита Hg 1/20 -BN, но и дополнительный пик Брэгга с центром при 2Θ ~ 39,7°. Рисунок 4a и увеличенное изображение (рис. 4b,c) сосредоточены на нанокомпозите Hg 1/20 -BN. Этот дополнительный дифракционный пик имеет ширину на полувысоте ∆Θ ~ 3,580°. Принимая во внимание как его угловое положение, так и относительную интенсивность к пику Hg (101), а также специфическую турбостратную структуру вмещающей матрицы BN 13 , этот второй пик Брэгга может быть отнесен только ко 2-му интенсивному пику Брэгга кристаллической Hg, т.е. кристаллографической ориентации Hg (003) ромбоэдрической α-фазы Hg «карта ASTM 09-0253». Чтобы подтвердить, что индексированные Hg (101) и Hg (003) являются правильными брэгговскими пиками ртути, происходящими от атомарно упорядоченной нано-Hg, внедренной в матрицу-хозяин BN-t, образец Hg 1/20 -BN был охлажден до ~ 78,0 К (рис.
Относительная интенсивность ртути (101) должна быть выше при той же объемной концентрации ртути. Как показано на рис. 3c, не только относительная интенсивность пика Брэгга Hg (101), относительно большая для нанокомпозита Hg 1/20 -BN, но и дополнительный пик Брэгга с центром при 2Θ ~ 39,7°. Рисунок 4a и увеличенное изображение (рис. 4b,c) сосредоточены на нанокомпозите Hg 1/20 -BN. Этот дополнительный дифракционный пик имеет ширину на полувысоте ∆Θ ~ 3,580°. Принимая во внимание как его угловое положение, так и относительную интенсивность к пику Hg (101), а также специфическую турбостратную структуру вмещающей матрицы BN 13 , этот второй пик Брэгга может быть отнесен только ко 2-му интенсивному пику Брэгга кристаллической Hg, т.е. кристаллографической ориентации Hg (003) ромбоэдрической α-фазы Hg «карта ASTM 09-0253». Чтобы подтвердить, что индексированные Hg (101) и Hg (003) являются правильными брэгговскими пиками ртути, происходящими от атомарно упорядоченной нано-Hg, внедренной в матрицу-хозяин BN-t, образец Hg 1/20 -BN был охлажден до ~ 78,0 К (рис. 4а). Помеченные Hg (101) и Hg (003) превращаются в более острые пики со значительным угловым сдвигом с 3 новыми менее интенсивными брэгговскими пиками Hg, соответствующими дифракции Hg (110), Hg (104) и Hg (113) твердых а-ромбоэдров. твердая Hg в дополнение к наличию многочисленных BN турбостатические дифракционные пики (рис. 4a и масштабная вставка). Таким образом, сосуществование двух пиков Брэгга, а именно, Hg(101) и Hg(003) на дифракционной картине нанокомпозита Hg 1/20 1/20 -BN при комнатной температуре, является прямым подтверждением кристаллизации при комнатной температуре. непроницаемой нано-Hg «〈Ø Hg 〉 TEM ~ 2,4 нм» в матрице-хозяине BN-t. Эти экспериментальные наблюдения подтверждают поверхностное атомное расслоение, согласующееся с упорядочением даже от 7 до 8 атомных плоскостей (〈a〉 ~ 3,0 Å), как показано на рис. 4d. Из-за давления паров объемной ртути, включение ртути в ее наноразмерной форме в химически инертную матрицу BN может значительно улучшить безопасное хранение ртути и свести к минимуму ее опасный аспект, особенно ртутные отходы, полученные из современных галогенных эффективных источников света.
4а). Помеченные Hg (101) и Hg (003) превращаются в более острые пики со значительным угловым сдвигом с 3 новыми менее интенсивными брэгговскими пиками Hg, соответствующими дифракции Hg (110), Hg (104) и Hg (113) твердых а-ромбоэдров. твердая Hg в дополнение к наличию многочисленных BN турбостатические дифракционные пики (рис. 4a и масштабная вставка). Таким образом, сосуществование двух пиков Брэгга, а именно, Hg(101) и Hg(003) на дифракционной картине нанокомпозита Hg 1/20 1/20 -BN при комнатной температуре, является прямым подтверждением кристаллизации при комнатной температуре. непроницаемой нано-Hg «〈Ø Hg 〉 TEM ~ 2,4 нм» в матрице-хозяине BN-t. Эти экспериментальные наблюдения подтверждают поверхностное атомное расслоение, согласующееся с упорядочением даже от 7 до 8 атомных плоскостей (〈a〉 ~ 3,0 Å), как показано на рис. 4d. Из-за давления паров объемной ртути, включение ртути в ее наноразмерной форме в химически инертную матрицу BN может значительно улучшить безопасное хранение ртути и свести к минимуму ее опасный аспект, особенно ртутные отходы, полученные из современных галогенных эффективных источников света. технологические системы.
технологические системы.
( a ) Профили дифракции рентгеновских лучей при комнатной температуре для Hg 1/20 -BN и температуры его азота. На вставке ( b , c ) показано увеличение пика Брэгга (101) и (003), связанное с ( d ) твердым а-ромбоэдрическим упорядочением атомов заключенной в клетку наноразмерной ртути с 7–8 упорядоченными атомами. слои.
Изображение в полный размер
В связи с наблюдаемым размерным эффектом стоит упомянуть различные предыдущие исследования удержания Hg в нанометрических конфигурациях. Среди них следует отметить экспериментальные наблюдения 2003 г. Касперовича и др. 14 , в 1998 г. Борисова и соавт. 15,16 и в 1986 г. Кумзерова и соавт. 17,18 . Точнее, Касперович и др. 14 провели ЯМР-исследования ртути, встроенной в ограниченную геометрию нанопористого углерода и нанопористого силикагеля с радиусом ~ 4,7 и ~ 3,9 нм соответственно. Процессы плавления-кристаллизации исследовали путем измерения относительной интегральной интенсивности сигналов ЯМР 199 Hg от жидкой фазы. Поскольку интегральная интенсивность сигнала ЯМР прямо пропорциональна количеству жидкой фазы в образце, затвердевание ртути приводит к уменьшению интенсивности ЯМР. Аналогичные исследования, проведенные с ртутью, заключенной в нанопористый углерод и силикагель, показали снижение температуры плавления-затвердевания на величину от 4 до 10 К относительно объемного значения, но отсутствие упорядочения атомов или затвердевания при комнатной температуре. В исследованиях Кумзерова и соавт. на нанопроволоках Hg. Ртуть была захвачена естественными нитевидными наносистемами; хризотил-асбест Mg 3 Si 2 O 5 (ОН) 4 . Этот природный диэлектрический материал-хозяин, который существует в виде регулярных нанопористых пучков, обладает открытыми каналами диаметром несколько десятков нанометров и длиной около ~ 1 см.
Процессы плавления-кристаллизации исследовали путем измерения относительной интегральной интенсивности сигналов ЯМР 199 Hg от жидкой фазы. Поскольку интегральная интенсивность сигнала ЯМР прямо пропорциональна количеству жидкой фазы в образце, затвердевание ртути приводит к уменьшению интенсивности ЯМР. Аналогичные исследования, проведенные с ртутью, заключенной в нанопористый углерод и силикагель, показали снижение температуры плавления-затвердевания на величину от 4 до 10 К относительно объемного значения, но отсутствие упорядочения атомов или затвердевания при комнатной температуре. В исследованиях Кумзерова и соавт. на нанопроволоках Hg. Ртуть была захвачена естественными нитевидными наносистемами; хризотил-асбест Mg 3 Si 2 O 5 (ОН) 4 . Этот природный диэлектрический материал-хозяин, который существует в виде регулярных нанопористых пучков, обладает открытыми каналами диаметром несколько десятков нанометров и длиной около ~ 1 см. Точнее, средний диаметр их полых каналов лежит в пределах 3,5–15 нм. Проведенные исследования ртутных нанопроволок, встроенных в эти трубчатые ограниченные наноструктуры, показали четкие эффекты размера при транспортировке, а также сверхпроводимость в дополнение к свойствам кристаллизации из расплава, но отсутствие кристаллизации при комнатной температуре. Как и в случае предыдущей нано-ртути, заключенной в нанопоры углерода и кремнезема, Kasperovich et al. 14 , последнее исследование кристаллизации расплава показало, однако, что соответствующая температура фазового перехода уменьшается с размером как ∆T = C/〈Ø〉 (41) в полном согласии с теоретическими моделями, предложенными до сих пор. И снова не наблюдалось атомного упорядочения/затвердевания при комнатной температуре такой нанортути, заключенной в естественную ограниченную геометрию матрицы хризотил-асбеста. Борисов и др. провели ультразвуковые исследования плавления-кристаллизации ртути, заключенной в нанопористые стекла Vycor со структурой пор 7,8 и 12 нм в среднем.
Точнее, средний диаметр их полых каналов лежит в пределах 3,5–15 нм. Проведенные исследования ртутных нанопроволок, встроенных в эти трубчатые ограниченные наноструктуры, показали четкие эффекты размера при транспортировке, а также сверхпроводимость в дополнение к свойствам кристаллизации из расплава, но отсутствие кристаллизации при комнатной температуре. Как и в случае предыдущей нано-ртути, заключенной в нанопоры углерода и кремнезема, Kasperovich et al. 14 , последнее исследование кристаллизации расплава показало, однако, что соответствующая температура фазового перехода уменьшается с размером как ∆T = C/〈Ø〉 (41) в полном согласии с теоретическими моделями, предложенными до сих пор. И снова не наблюдалось атомного упорядочения/затвердевания при комнатной температуре такой нанортути, заключенной в естественную ограниченную геометрию матрицы хризотил-асбеста. Борисов и др. провели ультразвуковые исследования плавления-кристаллизации ртути, заключенной в нанопористые стекла Vycor со структурой пор 7,8 и 12 нм в среднем. Еще раз было обнаружено, что температура кристаллизации изменяется; Точнее, температура кристаллизации T 9Было обнаружено, что кристаллизация 0323 изменяется как ≈ ~ 6 LS T b /L〈Ø пор 〉 с « LS » в качестве поверхностной плотности энергии на границе жидкость-твердое тело, а «» — молярный объем твердой фазы, а «L» — скрытая теплота с 〈Ø пор 〉 в качестве среднего размера пор. Последними недавними экспериментальными результатами, полученными в литературе и подлежащими рассмотрению в рамках этого вклада, является исследование дифракцией нейтронов фазового перехода кристаллизация-плавление ртути, встроенной в нанопористое стекло Vycor с размером пор около 7,0 нм (42). Интенсивность I (110) (Т) дифракционного пика Брэгга (110) отслеживали в зависимости от изменения температуры от 293,5°К до ~ 20°К. При комнатной температуре дифракционные пики Брэгга не наблюдались. Во время фазы охлаждения затвердевание началось только при 205 К, что привело к появлению пика Брэгга (110).
Еще раз было обнаружено, что температура кристаллизации изменяется; Точнее, температура кристаллизации T 9Было обнаружено, что кристаллизация 0323 изменяется как ≈ ~ 6 LS T b /L〈Ø пор 〉 с « LS » в качестве поверхностной плотности энергии на границе жидкость-твердое тело, а «» — молярный объем твердой фазы, а «L» — скрытая теплота с 〈Ø пор 〉 в качестве среднего размера пор. Последними недавними экспериментальными результатами, полученными в литературе и подлежащими рассмотрению в рамках этого вклада, является исследование дифракцией нейтронов фазового перехода кристаллизация-плавление ртути, встроенной в нанопористое стекло Vycor с размером пор около 7,0 нм (42). Интенсивность I (110) (Т) дифракционного пика Брэгга (110) отслеживали в зависимости от изменения температуры от 293,5°К до ~ 20°К. При комнатной температуре дифракционные пики Брэгга не наблюдались. Во время фазы охлаждения затвердевание началось только при 205 К, что привело к появлению пика Брэгга (110). Интенсивность пика увеличивалась с понижением температуры, что свидетельствует о росте концентрации кристаллической фазы. При T < 100 K наблюдалось насыщение интенсивности (110). Дифрактограммы при более низких температурах совпадали с объемной ртутью. Измерения в режиме нагрева выявили значительно большой гистерезис зависимости I(T).
Интенсивность пика увеличивалась с понижением температуры, что свидетельствует о росте концентрации кристаллической фазы. При T < 100 K наблюдалось насыщение интенсивности (110). Дифрактограммы при более низких температурах совпадали с объемной ртутью. Измерения в режиме нагрева выявили значительно большой гистерезис зависимости I(T).
По сравнению со всеми приведенными выше экспериментальными результатами по нано-ртути, внедренной в несколько пористых матриц, температура плавления-кристаллизации рассматриваемых наночастиц ртути, хотя и заметно снижена, намного ниже комнатной температуры и не согласуется с нашими текущими наблюдения и наблюдения Magnussen et al., Deutsch et al. 8 . Можно было бы выдвинуть два возможных объяснения: либо (i) размер соответствующих наночастиц Hg был недостаточно мал, чтобы испытать требуемый избыток порогового давления, связанного с поверхностным натяжением, ∆P типа Лапласа ~ 0,76 ГПа «ликвидуса» по отношению к ромбоэдрической фазе. переход, как показано на рис. 3, и/или (ii) сжимаемость матрицы-хозяина. Что касается первого предположения, связанного с размером, следует отметить, что размер наночастиц ртути находился в диапазоне от 2,5 до 15 нм. Такая величина размера действительно превышает критическое значение 〈Ø (0,76 ГПа) 〉 около 2,6 нм. Соответствующее поверхностное избыточное давление Лапласа ∆P составляет 0,39 и 0,065 ГПа для 2,6–15 нм соответственно. Таких значений недостаточно для преодоления жидкостно-ромбоэдрической границы фазовой диаграммы на рис. 1с, чего нельзя сказать о наночастицах Hg, захваченных током, в частности нанокомпозита Hg 1/20 -BN 〈Ø Hg 〉 TEM ~ 2,4 нм и ∆P 0,76 ГПа». Помимо размерного эффекта, сжимаемость матрицы-хозяина, естественно, может быть еще одним компонентом, способствующим стабильности наблюдаемой кристаллизации наночастиц ртути. Поскольку основная матрица BN находится в турбостратной структурной форме, ее сжимаемость является самой низкой по сравнению с рассматриваемыми матрицами-основами, такими как стекло Vycor, полимерный активированный уголь или хризотил-асбест 19,20 .
3, и/или (ii) сжимаемость матрицы-хозяина. Что касается первого предположения, связанного с размером, следует отметить, что размер наночастиц ртути находился в диапазоне от 2,5 до 15 нм. Такая величина размера действительно превышает критическое значение 〈Ø (0,76 ГПа) 〉 около 2,6 нм. Соответствующее поверхностное избыточное давление Лапласа ∆P составляет 0,39 и 0,065 ГПа для 2,6–15 нм соответственно. Таких значений недостаточно для преодоления жидкостно-ромбоэдрической границы фазовой диаграммы на рис. 1с, чего нельзя сказать о наночастицах Hg, захваченных током, в частности нанокомпозита Hg 1/20 -BN 〈Ø Hg 〉 TEM ~ 2,4 нм и ∆P 0,76 ГПа». Помимо размерного эффекта, сжимаемость матрицы-хозяина, естественно, может быть еще одним компонентом, способствующим стабильности наблюдаемой кристаллизации наночастиц ртути. Поскольку основная матрица BN находится в турбостратной структурной форме, ее сжимаемость является самой низкой по сравнению с рассматриваемыми матрицами-основами, такими как стекло Vycor, полимерный активированный уголь или хризотил-асбест 19,20 . Если это так, было бы мотивирующим исследовать нанокомпозит Hg 1/20 -BN с алмазной наковальней «DAC», чтобы выяснить, может ли ромбоэдрически-тетрагональный фазовый переход происходить при внешнем давлении меньше, чем требуемое 3,0 ГПа при комнатной температуре 21,22,23,24 .
Если это так, было бы мотивирующим исследовать нанокомпозит Hg 1/20 -BN с алмазной наковальней «DAC», чтобы выяснить, может ли ромбоэдрически-тетрагональный фазовый переход происходить при внешнем давлении меньше, чем требуемое 3,0 ГПа при комнатной температуре 21,22,23,24 .
В качестве предварительного заключения можно отметить, что размерные эффекты наблюдались в Hg в нанометрических конфигурациях Kasperovich et al. 14 , Борисов и др. 15 , Кумзеров и др. 17,18 атомного упорядочения и затвердевания не наблюдалось в связи с тем, что минимальные ограничительные размеры во всех случаях превышали пороговое значение 2,56 нм (Касперович (~ 4,7 и ~ 3,9 нм), Борисов (7,8 и 12 нм) и Кумзерова (3,5–15 нм).
Результаты моделирования и расчетов
Чтобы подтвердить приведенные выше экспериментальные наблюдения по атомному упорядочению/затвердеванию при комнатной температуре наноразмерной ртути, теория функционала плотности (DFT) при двух Для изучения взаимодействия Hg с поверхностью BN используются атомистическая и плоская волна с функционалами GGA-PBE, включая скалярные релятивистские эффекты и энергию дисперсии, а также квантовый эспрессо. Расчетный расчет, представленный ниже и в дополнительном разделе, указывает важность релятивистского влияния на характер и силу адсорбции наночастиц Hg на поверхности BN, точнее, расчеты по теории функционала плотности (DFT). zed, чтобы охарактеризовать связь наноразмерного кластера / поверхности Hg с поверхностью BN. Расчет DFT на двух уровнях теории, атомистической и плосковолновой, использовался с учетом релятивистского эффекта и дисперсионной поправки.
Расчетный расчет, представленный ниже и в дополнительном разделе, указывает важность релятивистского влияния на характер и силу адсорбции наночастиц Hg на поверхности BN, точнее, расчеты по теории функционала плотности (DFT). zed, чтобы охарактеризовать связь наноразмерного кластера / поверхности Hg с поверхностью BN. Расчет DFT на двух уровнях теории, атомистической и плосковолновой, использовался с учетом релятивистского эффекта и дисперсионной поправки.
В рамках расчетов DFT кластер Hg с гранецентрированной кубической «ГЦК» структурой (рис. 5а) был получен как стабильная структура с функционалами PBE, BP86 и PW91 25 . Аналогично, расчеты DFT были выполнены с использованием набора программ Amsterdam Modeling (ADF) 26 . Аппроксимация обобщенного градиента (GGA) Пердью, Берка и Эрнзерхофа (PBE) 27 в базисном наборе с двойной \ (\ дзета \) поляризованной замороженной сердцевиной (DZP) из библиотеки базисных наборов ADF. Влияние релятивистских эффектов рассмотрено путем сравнения нерелятивистского (Н. Р.) и скалярно-релятивистского (С.Р.) гамильтониана ЗОРА 5,28 . Дисперсионное взаимодействие осуществлялось с помощью поправок Grimme DFT-D3 29,30 . Рисунок 5 ) 2 слоя поверхности Hg (101) на поверхности hBN и ( d ) поверхности Hg (003) на поверхности hBN. Структуры оптимизированы с использованием базисных наборов плоских волн на уровне теории PBE/D3, включая скалярный релятивистский эффект в псевдопотенциалах. Изо-значение разности зарядов установлено равным 0,0001 е/а.е. 3 . Желтый и синий цвета обозначают положительные и отрицательные уровни, соответствующие присоединению и отдаче электронов.
Р.) и скалярно-релятивистского (С.Р.) гамильтониана ЗОРА 5,28 . Дисперсионное взаимодействие осуществлялось с помощью поправок Grimme DFT-D3 29,30 . Рисунок 5 ) 2 слоя поверхности Hg (101) на поверхности hBN и ( d ) поверхности Hg (003) на поверхности hBN. Структуры оптимизированы с использованием базисных наборов плоских волн на уровне теории PBE/D3, включая скалярный релятивистский эффект в псевдопотенциалах. Изо-значение разности зарядов установлено равным 0,0001 е/а.е. 3 . Желтый и синий цвета обозначают положительные и отрицательные уровни, соответствующие присоединению и отдаче электронов.
Изображение полного размера
Энергии адсорбции рассчитывали в приближении обобщенного градиента (GGA-PBE). Исследовано влияние релятивистских и дисперсионных поправок на энергию. Результаты, по-видимому, указывают на то, что кластер Hg слабо связан с поверхностью BN, поскольку энергии адсорбции малы (менее ~ 1 эВ), что в основном связано с дисперсионными взаимодействиями. Релятивистские эффекты увеличивают энергию связи порядка ~ 0,01 эВ, но значительно изменяют энергетическую щель ВЗМО-НСМО.
Релятивистские эффекты увеличивают энергию связи порядка ~ 0,01 эВ, но значительно изменяют энергетическую щель ВЗМО-НСМО.
ГЦК-кластер Меркурия на ленте hBN (рис. 5б) изучался с помощью Quantum ESPRESSO 31 . В направлениях y – z вакуум составляет 10 Å. Метод GGA-PBE был использован для описания обменно-корреляционного функционала вместе с ультрамягким псевдопотенциалом 9,32 для всех атомов. Для выборки зоны Бриллюэна 33,34,35,36 использовалась сетка сетки Монхороста-Пака из k-точек \(4\times 1\times 1\). Заселение электронных состояний определяли с помощью гауссова размытия шириной 0,01 эВ и проводили обрезание реальной космической орбиты 8,4 Å.
Разность зарядов между кластером ртути, одним слоем Hg (101), двумя слоями Hg (101) и поверхностью hBN представлена на рис. 5. Изо-значение разности зарядов зафиксировано на уровне 0,0001 e а.е. −3 . Желтый и синий цвета указывают на положительные и отрицательные уровни, соответствующие накоплению и потере плотности электронного заряда при адсорбции атомов Hg. Изменения плотности заряда наиболее выражены в случае адсорбции Hg поверхностями (101) и (003), так как энергии взаимодействия также указывают на более прочную связь. Как правило, накопление заряда происходит в основном вокруг атомов Hg.
Изменения плотности заряда наиболее выражены в случае адсорбции Hg поверхностями (101) и (003), так как энергии взаимодействия также указывают на более прочную связь. Как правило, накопление заряда происходит в основном вокруг атомов Hg.
С точки зрения технологического применения, еще не представленной, скажем, и с учетом полученных теоретических и экспериментальных результатов, может быть достаточно безопасным предложить этот подход в качестве потенциального способа хранения Hg при комнатной температуре. Твердый аспект наноразмерной ртути сводит к минимуму опасность ее паров при комнатной температуре и, следовательно, идею безопасного хранения.
Выводы
Размерный эффект в наноразмерной ртути, диспергированной в двумерной матрице-хозяине BN, наблюдался при комнатной температуре. Для наночастиц Hg с диаметром меньше порогового значения 2,5 нм, как определено фазовой диаграммой P – T, наблюдается чистая кристаллизация, проявляющаяся через поверхностное атомное расслоение примерно из 7–8 атомных слоев. Ниже такого порогового значения 2,5 нм Hg является твердым при комнатной температуре с ромбоэдрической кристаллографической структурой со средним параметром решетки 〈a〉 ~ 3,005 Å. Теоретическое моделирование показало, что использование различных кодов и аппроксимаций указывало на кристально чистое накопление и потерю плотности электронного заряда при адсорбции атомов Hg. Изменения плотности заряда наиболее выражены в случае адсорбции Hg поверхностями (101) и (003). Последнее подтверждает экспериментально наблюдаемое атомное упорядочение/затвердевание наноразмерной ртути при комнатной температуре. Учитывая давление паров жидкой объемной ртути, включение ртути в ее наноразмерной форме в химически инертную матрицу BN может значительно улучшить безопасное хранение ртути и свести к минимуму ее опасный аспект, особенно ртутные отходы, полученные из современных галогеноэффективных световые системы. В качестве продолжения этого фундаментального исследования необходимо провести синхротронные методы, такие как EXAFS, SAXS и порошковый XRD.
Ниже такого порогового значения 2,5 нм Hg является твердым при комнатной температуре с ромбоэдрической кристаллографической структурой со средним параметром решетки 〈a〉 ~ 3,005 Å. Теоретическое моделирование показало, что использование различных кодов и аппроксимаций указывало на кристально чистое накопление и потерю плотности электронного заряда при адсорбции атомов Hg. Изменения плотности заряда наиболее выражены в случае адсорбции Hg поверхностями (101) и (003). Последнее подтверждает экспериментально наблюдаемое атомное упорядочение/затвердевание наноразмерной ртути при комнатной температуре. Учитывая давление паров жидкой объемной ртути, включение ртути в ее наноразмерной форме в химически инертную матрицу BN может значительно улучшить безопасное хранение ртути и свести к минимуму ее опасный аспект, особенно ртутные отходы, полученные из современных галогеноэффективных световые системы. В качестве продолжения этого фундаментального исследования необходимо провести синхротронные методы, такие как EXAFS, SAXS и порошковый XRD.
Ссылки
Pyykkö, P. Релятивистские эффекты в структурной химии. Доп. Квантовая хим. 11 , 353 (1978).
ОБЪЯВЛЕНИЕ Статья Google ученый
Wilkinson, M.C. Поверхностные свойства ртути. Хим. Ред. 72 (6), 575 (1972).
КАС Статья Google ученый
Эванс, Р. Метод Монте-Карло для изучения фазовых переходов: обзор некоторых последних достижений. J. Phys. С. 7 , 2808 (1974).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Амокране, С. и др. Псевдоатомная теория границы раздела жидкость–пар простых металлов. J. Phys. хим. 75 , 5543 (1982).
Артикул Google ученый
- «>
Ланг, Северная Дакота и др. Теория металлических поверхностей. Физ. Ред. B 12 , 4555 (1970).
ОБЪЯВЛЕНИЕ Статья Google ученый
Чакон, Э. и др. Нелокальный функционал кинетической энергии для неоднородных электронных систем. Физ. Rev. B. 32 , 7868 (1985).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Гомес, Массачусетс и др. ” Электронная структура: Широкополосные, узкополосные и сильно коррелированные системы. Физ. B 46 , 6665 (1992).
Артикул Google ученый
Магнуссен, М. и др. Рентгеновские измерения отражательной способности поверхностных слоев жидкой ртути. Физ. Преподобный Летт. 74 (22), 4444 (1995).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
- «>
Bafile, U. и др. Изучение молекулярной динамики Ab initio статических, динамических и электронных свойств жидкой ртути при комнатной температуре. J. Некристалл. Твердые вещества. 250–252 , 35 (1999).
ОБЪЯВЛЕНИЕ Статья Google ученый
Bafile, U. и др. Микроскопическая структура жидкой ртути по данным нейтронной и рентгеновской дифракции. Физика. Б 276–278 , 452 (2000).
ОБЪЯВЛЕНИЕ Статья Google ученый
Янг, Б. Фазовая диаграмма элементов (издательство Калифорнийского университета, 1992).
Google ученый
Гастон, Н. и др. Структура решетки ртути: влияние электронной корреляции. Физ. Ред. B 74 (9), 094102 (2006 г.).
ОБЪЯВЛЕНИЕ Статья Google ученый
- «>
Мацуи Т. и др. Синтез и характеристика наночастиц оксида церия, покрытых турбостратным нитридом бора. Дж. Матер. хим. 2003 (13), 622–627 (2003).
Google ученый
Касперович В. С., Чарная Е. В., Тиен К. и Вур К. С. ЯМР ртути в пористом угле и силикагеле. Физ. Твердотельный 45 (9), 1802 (2003).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Борисов Б.Ф. и др. Затвердевание и плавление ртути в пористом стекле по данным ЯМР и акустических методов. Физ. Rev. B. 58 , 5329 (1998).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Мишель Д., Борисов Б. Ф., Чарная Е. В. Затвердевание и плавление галлия и ртути в пористых стеклах по данным ЯМР и акустических методов. Наноструктур.
 Матер. 12 , 515 (1999).
Матер. 12 , 515 (1999).Артикул Google ученый
Кумзеров Ю. А. В Электронные свойства почти одномерных металлических проводов . Кандидатская диссертация, Ленинград (1986).
Кумзеров Ю.А. Материалы семинара WTEC по российским исследованиям и разработкам в области наночастиц и наноструктурных материалов 33 (Международный научно-исследовательский институт технологий, 1997).
Google ученый
Баррет Дж. С. Структура ртути при низких температурах. Acta Кристаллогр. 10 , 58 (1957).
Артикул Google ученый
Кристенсон Х.К. и Физ Дж. Влияние изоляции на замерзание и таяние. Конденс. Иметь значение. 13 , R95 (2001).
КАС Статья Google ученый
- «>
Вахрушев С.Б., Кумзеров Ю.В. А., Набережнов А. А. Замерзание и плавление ртути в пористом стекле. Физ. Rev. B. 52 , 4772 (1995).
ОБЪЯВЛЕНИЕ Статья Google ученый
Донохью, Дж. Структура элементов 231 (Wiley, 1974).
Google ученый
Мориарти, Дж. А. Плотно-функциональная формулировка обобщенной теории псевдопотенциала. II. Физ. Rev. B. 26 , 1754 (1982).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Соложенко В. Л., Соложенко Е. Г. Уравнение состояния турбостратного нитрида бора. Рез. высокого давления 21 , 115 (2001).
ОБЪЯВЛЕНИЕ Статья Google ученый
Гастон, Н., Паулюс, Б.
 , Росцишевский, К., Швердтфегер, П. и Столл, Х. Решетчатая структура ртути: влияние электронной корреляции. Физ. Ред. B 74 , 094102 (2006 г.).
, Росцишевский, К., Швердтфегер, П. и Столл, Х. Решетчатая структура ртути: влияние электронной корреляции. Физ. Ред. B 74 , 094102 (2006 г.).ОБЪЯВЛЕНИЕ Статья Google ученый
АДФ2019. 01, Теоретическая химия . В. У., СКМ. http://www.scm.com.
Пердью, П., Берк, К. и Эрнзерхоф, М. Упрощение обобщенного градиентного приближения. Физ. Преподобный Летт. 77 , 3865 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ван Ленте, Э., Бэрендс, Э.Дж. и Снайдерс, Дж.Г. Релятивистская полная энергия с использованием регулярных приближений. J. Chem. физ. 101 , 9783 (1994).
ОБЪЯВЛЕНИЕ Статья Google ученый
Гримме, С., Энтони, Дж., Эрлих, С.
 и Криг, Х. Непротиворечивая и точная параметризация ab initio коррекции функциональной дисперсии плотности (DFT-D) для 94 элементов Pu. J. Chem. физ. 132 , 154104 (2010).
и Криг, Х. Непротиворечивая и точная параметризация ab initio коррекции функциональной дисперсии плотности (DFT-D) для 94 элементов Pu. J. Chem. физ. 132 , 154104 (2010).ОБЪЯВЛЕНИЕ Статья Google ученый
Гримм С., Эрлих С. и Геригк Л. Влияние функции демпфирования в теории функционала плотности с поправкой на дисперсию. Дж. Вычисл. хим. 32 , 1456 (2011).
КАС Статья Google ученый
Scandolo, S. и др. Первопринципные коды для вычислительной кристаллографии в пакете Quantum-ESPRESSO. З. Кристаллогр. 220 , 574 (2005).
КАС Статья Google ученый
Lejaeghere, K. et al. Воспроизводимость в расчетах теории функционала плотности твердых тел. Наука 351 (6280), 1415 (2016).

КАС Статья Google ученый
Монкхорст, Х. Дж. и Пак, Дж. Д. Специальные точки для интегрирования зоны Бриллюэна. Физ. Ревизия B 13 , 5188 (1976).
ОБЪЯВЛЕНИЕ MathSciNet Статья Google ученый
Сингх, П.П. От гексагональной плотной упаковки к ромбоэдрической структуре: релятивистские эффекты в Zn, Cd и Hg. Физ. Преподобный Летт. 72 , 2446 (1994).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ким В.Ю., Наутиал Т., Юн С.Дж. и Ким К.С. Аномальное поведение Меркурия в одном измерении: расчеты функционала плотности. Физ. Ред. B 71 , 113104 (2005 г.).
ОБЪЯВЛЕНИЕ Статья Google ученый
Paulus, B.
 and Rosciszewski, K. Очень точная кривая потенциальной энергии для димера ртути. Хим. физ. лат. 394 , 96 (2004).
and Rosciszewski, K. Очень точная кривая потенциальной энергии для димера ртути. Хим. физ. лат. 394 , 96 (2004).ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ссылки на скачивание
Благодарности
Эта исследовательская программа была щедро поддержана грантами Университета Южной Африки (UNISA), Национального исследовательского фонда Южной Африки (NRF), iThemba LABS, Министерства Европы и иностранных дел Франции через программу ADESFA II), Организация женщин за науку в развивающихся странах (OWSD) и Абдул Салам ICTP через Африканскую сеть нанонаук (NANOAFNET), а также через Африканский лазерный центр (ALC), которым мы благодарны. Один из нас (М.М.) желает посвятить этот вклад г-же Дж. Салеми, проф. Ф.Р.Л. Шёнингу и проф. М.О. Осман Ндвандве.
Информация об авторе
Авторы и организации
ЮНЕСКО-ЮНИСА-iTLABS/NRF Африканская кафедра нано-наук и нанотехнологий, CGS, Южно-Африканский университет, Макленук-Ридж, Претория, 0001, Южная Африка
Н.
 К. Ана , Р. Морад, М. Акбари, М. Хенини, Ф. Хак, А. Жибо и М. Мааза
К. Ана , Р. Морад, М. Акбари, М. Хенини, Ф. Хак, А. Жибо и М. МаазаNANOAFNET, iThemba LABS — Национальный исследовательский фонд Южной Африки, 1 Old Faure Road, Western Cape, 7129, Южная Африка
Н. Кана, Р. Морад, М. Акбари, М. Хенини, Ф. Хак, А. Жибо и М. Мааза
Факультет физики и астрономии Ноттингемского университета, Ноттингем, NG7 2RD7, Великобритания
М. Хенини
Международный центр теоретической физики (ICTP), Str. Costiera, 11, 34151, Trieste, Italy
J. Niemela
Физический факультет Университета Раджшахи, Дакха, Бангладеш
F. Hacque
IMMM, OCN University of Le Maine, UMR, 6283 Мессиан, 72085, Седекс Ле-Ман 09, Франция
A. Gibaud
Авторы
- N. Kana
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- R.
 Morad
MoradПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- М. Акбари
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- M. Henini
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- J. Niemela
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- F. Hacque
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- A. Gibaud
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- M. Maaza
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Вклады
Н. К.: фаза синтеза и различные физико-химические характеристики, Р.М.: моделирование и прогнозы DFT, магистр искусств: прогнозы молекулярной динамики, М.Х.: написание рукописи и обсуждение фазы фазовых переходов, Дж.Н. : Теоретические дискуссии о жидкостях и теории, связанные с, FH: Моделирование и литература, связанная с поверхностным атомным расслоением, AG Атомное расслоение и поверхностные и межфазные явления, а также интерпретация спектров рентгеновской дифракции, MM: Концепция, моделирование, интерпретация результатов и написание рукописи .
К.: фаза синтеза и различные физико-химические характеристики, Р.М.: моделирование и прогнозы DFT, магистр искусств: прогнозы молекулярной динамики, М.Х.: написание рукописи и обсуждение фазы фазовых переходов, Дж.Н. : Теоретические дискуссии о жидкостях и теории, связанные с, FH: Моделирование и литература, связанная с поверхностным атомным расслоением, AG Атомное расслоение и поверхностные и межфазные явления, а также интерпретация спектров рентгеновской дифракции, MM: Концепция, моделирование, интерпретация результатов и написание рукописи .
Авторы переписки
Переписка с Н. Кана или М. Мааза.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация.

Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на первоначальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Скачать PDF
Научные исследования подтверждают токсичность ртути, но Садхгуру продолжает рекомендовать ее для индийских традиционных лекарств
- Союзный кабинет Индии одобряет ратификацию Минаматской конвенции о ртути для запрета ее использования. Садхгуру (фонд Иша) одобряет использование ртути в аюрведических и сиддхских лекарствах.
- Садхгуру предается лженауке о ртути, утверждая, что может превратить ее в твердое состояние из жидкости, «просто держа ее в руке».
- Базовый химический состав ртути: чистая ртуть представляет собой жидкость, тогда как соединения, такие как HgS, представляют собой встречающиеся в природе твердые вещества, оба нейротоксичны.
- Во всем мире загрязнение ртутью происходит в результате добычи полезных ископаемых и сжигания ископаемого топлива, в то время как в Индии широко распространен прием традиционных лекарственных средств, содержащих ртуть.

- Препараты Сиддха и Аюрведа содержат токсичную ртуть и другие тяжелые металлы в количествах, превышающих максимально допустимый предел (Saper, 2008).
- Сообщалось о случаях отравления ртутью после употребления аюрведических и сиддхских препаратов, которые приводили к тяжелым неврологическим повреждениям и параличу у взрослых, последствия усугублялись у детей.
- С точки зрения современных научных исследований очевидно, что ртуть опасно токсична во всех формах, включая ее использование в традиционной медицине.
8 февраля 2018 года Йоги Садхгуру из фонда Иша написал в Твиттере следующее:
«Должно быть разрешено ответственное использование ртути в медицинских и йогических целях. Индийская алхимия в значительной степени основана на ртути, и потеря ее из-за неосведомленной паранойи будет большой потерей для человечества».
Это заявление было сделано после 7 th февраля 2018 года, когда кабинет министров Индии согласился утвердить введение запрета на использование ртути в рамках Минаматской конвенции о ртути, которая является « глобальным договором о защите здоровья человека». и окружающую среду от неблагоприятного воздействия ртути ».
и окружающую среду от неблагоприятного воздействия ртути ».
Индия ратифицирует #Минаматскую конвенцию о ртути. Кабинет Союза под председательством премьер-министра Модиджи одобрил это предложение. Он направлен на защиту здоровья человека и окружающей среды от вредного воздействия ртути. Однако Конвенция исключает использование ртути в аюрведических, сиддхских и унани-медицинских препаратах. pic.twitter.com/1ilj7REDN3
— Dr. Harsh Vardhan (@drharshvardhan) 7 февраля 2018 г.
Эта Конвенция привлекает внимание к широко распространенному глобальному загрязнению ртутью в результате деятельности человека, такой как добыча полезных ископаемых и сжигание ископаемого топлива, в результате которой этот встречающийся в природе, но токсичный тяжелый металл высвобождается из земная кора.
Хотя ртуть имеет более широкое электрическое применение, такое как использование в батареях и люминесцентных лампах, а также в метеорологическом оборудовании, таком как барометры и термометры.
В Индии он также используется для изготовления традиционных индийских лекарств, таких как Аюрведа и Сиддха. Кроме того, в недавнем исследовании сообщалось о высоком содержании ртути и мышьяка в традиционных китайских лекарствах (Furuta and Sato, 2016).
В статье Садхгуру утверждает, что он может затвердевать и превращать ртуть в жидкость, просто держа ее в руке и «подпитывая» ее энергией при комнатной температуре. По словам Садхгуру, польза такой затвердевшей ртути связана со здоровьем людей, психическим состоянием и экономикой, при этом он называет это «субъективной наукой».
» Энергия» ртути или любого другого материала путем «удерживания» посредством процесса, называемого «освящение через божественное реверберацию», ртуть может быть сделана «вечной» материал, который мы можем найти. Ртуть — одно из самых плотных веществ, и она находится в жидкой форме — это единственный жидкий металл. Как только вы активируете это, оно останется таким же в течение десяти, пятнадцати тысяч лет. Если поддерживать правильную ситуацию, она может оставаться такой на сто тысяч лет»9.1308
Если поддерживать правильную ситуацию, она может оставаться такой на сто тысяч лет»9.1308
Далее Садхгуру объяснил, что:
«Именно поэтому большинство (шива) лингамов основаны на ртути. Ртутные лингамы в Тертакундах представляют собой затвердевшую ртуть — 99,2% чистой ртути — 0,8% примеси — это потому, что лаборатории не в состоянии ее удалить. Согласно современной химии, вы не можете затвердеть ртуть при комнатной температуре; вы можете затвердеть ртуть, только если вы доведете ее до -38 градусов по Цельсию. Но я возьму его в руки и затвердею и сжижу при комнатной температуре. Это индийская алхимия, и это способ зарядить энергией любое пространство. Мы видели, как феноменально изменилось состояние здоровья людей, их психическое состояние и даже их экономическое положение у людей, которые взяли с собой затвердевшие формы ртути».
“ Вся эта наука о затвердевании и возбуждении ртути называется Раса Вайдья. Это субъективная наука, потому что если вам нужно превратить одну вещь во что-то другое, вам нужно какое-то добавление, вычитание, изменение температуры — вы должны что-то сделать, иначе этого не произойдет. Но теперь при комнатной температуре ртуть затвердевает без каких-либо добавок. Это не может быть физической, объективной наукой. Это должна быть субъективная наука».
Но теперь при комнатной температуре ртуть затвердевает без каких-либо добавок. Это не может быть физической, объективной наукой. Это должна быть субъективная наука».
Даже в учебнике по естественным наукам для начальной школы указано, что при нормальных условиях температуры и давления (NTP), т.е. 20°C (293,15 K, 68 °F) и абсолютное давление 1 атм (14,696 фунтов на квадратный дюйм, 101,325 кПа), чистая ртуть действительно жидкая .
Чистая ртуть, даже с ее примесями, не может существовать в твердом состоянии на НТП. Единственный способ, которым ртуть может существовать в твердом состоянии, — это соединение с другими элементами в виде химического соединения. Этот другой элемент (например, сера) может существовать как другой ион в соединении (HgS), а не как примесь.
В двух окислительных состояниях ртуть может связываться с другими элементами, такими как кислород и сера, превращаясь в твердое вещество при комнатной температуре и давлении (NTP). Интересно, что наиболее распространенным источником затвердевшей ртути в природе является горная порода под названием 9.1307 киноварь , представляющая собой соединение ртути и серы- HgS .
Интересно, что наиболее распространенным источником затвердевшей ртути в природе является горная порода под названием 9.1307 киноварь , представляющая собой соединение ртути и серы- HgS .
Сульфид ртути (II) представляет собой каменистое кристаллическое соединение, диморфное, с оптически активной α-формой (красная) и черной β-формой. Его можно добывать в большинстве географических мест, где извлекаются полезные ископаемые, и тысячи лет он использовался для извлечения ртути. Именно благодаря такой добыче ртуть распространяется и становится глобальным загрязнителем экосистемы.
В той же статье Садхгуру, подчеркивающей важность ртути в аюрведе и сиддхе, он утверждал, что это императив Сиддхи должен содержать ртуть . Кроме того, он утверждал, что тяжелые болезни излечиваются путем нанесения на тело «затвердевшей» ртути.
«Индийские системы медицины, такие как Аюрведа и Сиддха Вайдья, ежедневно используют ртуть. Сиддха Вайдья не может действовать без ртути. Ртуть является наиболее важным ингредиентом в Сиддха Вайдья, а также в некоторых аюрведических продуктах. Эта практика существует уже тысячи лет. Потребление ртути является неотъемлемой частью йогической практики. Мы знаем, что это делает с системой. В Индии вы увидите людей с ртутными шариками на шее. Есть множество людей, которые вылечились от очень серьезных иммунологических заболеваний, просто нанеся на свое тело кусочек затвердевшей ртути».
Ртуть является наиболее важным ингредиентом в Сиддха Вайдья, а также в некоторых аюрведических продуктах. Эта практика существует уже тысячи лет. Потребление ртути является неотъемлемой частью йогической практики. Мы знаем, что это делает с системой. В Индии вы увидите людей с ртутными шариками на шее. Есть множество людей, которые вылечились от очень серьезных иммунологических заболеваний, просто нанеся на свое тело кусочек затвердевшей ртути».
Медицина сиддхов: одна из форм древних индийских систем традиционной медицины, зародившаяся в древнем регионе на юге Индии (в широком смысле, современный Тамил Наду и окружающий его географический регион).
Это буква «S» в AYUSH ( A yurverda, Y oga, U nani, S iddha и H омеопатия) системы традиционной индийской медицины, активно продвигаемой в качестве господствующей системы медицины. действующее правительство Индии, а также имеет собственное Министерство AYUSH, независимое от Министерства здравоохранения и социального обеспечения.
В Индии процессы, включающие использование и добавление ртути, существуют не только в промышленном производстве электротехники, но и в лекарствах Аюрведы, Сиддхи и Унани.
Поскольку Минаматская конвенция направлена на защиту здоровья человека и окружающей среды от неблагоприятного воздействия ртути, она исключает использование ртути в аюрведических, сиддхских и унани-препаратах . Это решение было одобрено министром окружающей среды Союза Доктор Харш Вардхан вместе с решением Кабинета.
Если традиционная индийская медицинская практика сиддхов по существу зависит от использования ртути, то токсичность и дозировка этих препаратов для человека должны подвергаться сомнению в соответствии с научными принципами современных исследований.
В 2002 году Бруссард и его коллеги опубликовали метаанализ различных исследований токсичности ртути, чтобы сделать вывод о том, что ионы ртути оказывают токсическое действие за счет осаждения белков, ингибирования ферментов и общего коррозионного действия. В статье также обсуждались механизмы различных путей воздействия, т.е. воздух, вода и пища, и его пороговые пределы, а также симптомы острого и хронического воздействия.
В статье также обсуждались механизмы различных путей воздействия, т.е. воздух, вода и пища, и его пороговые пределы, а также симптомы острого и хронического воздействия.
Очевидно, встречающаяся в природе минеральная руда ртути, такая как Cinnabar , также токсична, и эта токсичность была обнаружена даже в Древней Римской империи (P. Wexler, 2014 & R.J. Myers, 1986) и подтверждена современной медициной (H.Y. Сон и др., 2010).
Исследовательская статья в 2008 году, в которой задокументировано содержание ртути и других тяжелых металлов, таких как свинец, мышьяк, олово, превышающее максимально допустимое содержание, была опубликована доктором Робертом Б. Сапером , доктором медицинских наук, магистром здравоохранения, Департаментом по делам семьи. медицины, Медицинская школа Бостонского университета.
Несмотря на то, что эти препараты содержат небольшое количество ртути, человеческому организму требуется только небольших количеств, чтобы вызвать длительное необратимое неврологическое повреждение .
Процитированная выше статья Сапера, в которой описывалось несколько аюрведических препаратов и предполагалось, что уровни потребления таких веществ, как ртуть, свинец и мышьяк, значительно превышают допустимый предел как у взрослых, так и у детей, если эти аюрведические препараты употреблялись в соответствии с рекомендуемая производителем дозировка. В том же исследовании Saper (2008) цифра заявила, что , 20% протестированных аюрведических препаратов содержали тяжелые металлы и 9% — ртуть из 70 протестированных препаратов . В приведенном ниже списке указаны названия некоторых производителей лекарств в Индии, рецептуры которых содержат высокие дозы тяжелых металлов. По оценкам, более 75 000 новорожденных в Соединенных Штатах каждый год могут подвергаться повышенному риску нарушения обучаемости, связанного с воздействием метилртути внутриутробно.
Существует несколько отчетов ВОЗ об опасных веществах, в которых подчеркивается пагубное воздействие ртути на здоровье человека.
Широко сообщалось о нескольких случаях употребления традиционных лекарственных средств на основе ртути, что приводило к проблемам со здоровьем.
В 2015 году у 55-летней женщины из Гамбурга был обнаружен « рекордный» уровень токсичных тяжелых металлов в организме после приема аюрведических лекарств , прописанных ей во время недельного пребывания в спа-отеле на Шри-Ланке. .
Она привезла лекарства с собой в Германию, и продолжала принимать их в течение нескольких недель, пока в июле не потеряла сознание и не была доставлена в больницу с тяжелым неврологическим повреждением.
Тобиас Мейер, главный врач нефрологического отделения клиники Асклепиос Бармбек в Гамбурге, лечил женщину и сказал, что лекарство содержит в 566 110 раз больше допустимого уровня ртути. Согласно анализу Центрального института профессиональной и морской медицины Гамбурга, женщина проглотила в общей сложности 213 г ртути .
В 2016 году в Керале другой молодой женщине давали лекарство Сиддха от проблем с кожей, пока ее конечности не были парализованы . Другое лекарство было дано от этого нового паралича, по сути, побочного эффекта лекарства, ошибочно диагностированного как ревматизм, до тех пор, пока якобы не было повреждено 80% ее нервов.
Другое лекарство было дано от этого нового паралича, по сути, побочного эффекта лекарства, ошибочно диагностированного как ревматизм, до тех пор, пока якобы не было повреждено 80% ее нервов.
Согласно отчету об исследовании ртути, представленному Конгрессу США Национальным центром экологических публикаций (NSCEP), она может даже напрямую всасываться при прямом контакте с незащищенной или, в некоторых случаях (метилртуть), недостаточно защищенной кожей.
Ртуть в любой форме опасно опасна для человека, если ее количество может увеличиваться в пищевой цепи – в процессе, называемом биоусилением, при употреблении продуктов питания (например, рыбы и растений) и лекарств, содержащих ртуть. Поскольку ртуть всасывается на 90 % через желудочно-кишечный тракт и оказывает быстрое действие с более высокой токсичностью, она особенно опасна для детей. когнитивные функции, такие как двигательная активность, внимание, зрительно-пространственные изменения, язык и память (см. рисунок выше)
В этой статье мы рассмотрели различные утверждения Садхгуру относительно использования ртути в традиционных индийских лекарствах, таких как Сиддха. Рецензируемая научная литература по ртути четко устанавливает ее токсичность при проглатывании или всасывании.
Рецензируемая научная литература по ртути четко устанавливает ее токсичность при проглатывании или всасывании.
Кроме того, было зарегистрировано несколько инцидентов, связанных с токсичностью ртути, причиняющей прямой вред здоровью человека, особенно в связи с использованием традиционных лекарств.
В то время как вся лженаука должна быть тщательно изучена с использованием современной методологии научных исследований, правительство должно более серьезно относиться к этому виду опасной лженауки, особенно когда ее одобряют такие общественные деятели, как Садхгуру.
Пожертвовать альтернативным новостям!
Независимая журналистика, которая говорит правду властям и свободна от корпоративного и политического контроля, возможна только тогда, когда люди вносят свой вклад в то же самое. Пожалуйста, рассмотрите возможность пожертвования в поддержку этого усилия по борьбе с дезинформацией и дезинформацией.
Чтобы сделать мгновенное пожертвование, нажмите кнопку «Пожертвовать сейчас» выше. Для получения информации о пожертвовании посредством банковского перевода/чека/DD нажмите здесь.
Для получения информации о пожертвовании посредством банковского перевода/чека/DD нажмите здесь.
11 Важные факты – Lambda Geeks
Ртуть находится в жидкой фазе при комнатной температуре; давайте посмотрим, может ли ртуть проводить электричество или нет в этой статье.
Ртуть проводит электричество, потому что она обладает металлическими свойствами и отличными свойствами объемного расширения при повышении температуры. Электроны ртути могут свободно двигаться, чтобы проводить поток электрического потока по поверхности материи .
Ртуть имеет два валентных электрона, которые можно легко отделить от этого металла для получения электричества. Через ртуть проходит достаточное количество электрического потока на единицу площади поперечного сечения. Давайте обсудим далее в этой статье, как эти свободные электроны помогают проводить электричество.
Ртуть является изолятором или проводником? Все металлы являются проводниками, а не изоляторами. Обоснуем, является ли ртуть изолятором или проводником.
Обоснуем, является ли ртуть изолятором или проводником.
Ртуть металл является проводником, так как пропускает через себя электричество и тепло. Ртуть находится в жидком состоянии при комнатной температуре, также быстро реагирует на высокую температуру, поэтому она используется в таких приборах, как термометры и термостаты.
Ртуть не является плохим проводником тепла или электричества. Следовательно, он не может быть классифицирован как изолятор. В жидком состоянии он является плохим проводником тепла по сравнению с твердым состоянием.
Как ртуть проводит электричество?Вещество проводит электричество, когда свободные электроны показывают переход с одного энергетического уровня на другой. Давайте посмотрим, как ртуть проводит электричество.
Ртуть отдает один или два своих валентных электрона, образуя электроположительные ионы, и поэтому она может проводить электричество. Валентный электрон захватывает химическую/электрическую энергию, возбуждается на более высоком энергетическом уровне и начинает проводить.
Проведение электричества возможно благодаря плотности электрического потока, проходящего через материал. Давайте обсудим, почему ртуть способна проводить электричество.
Меркурий имеет два свободных электрона в самой внешней оболочке, присутствующей в его 6-й оболочке, с большим расстоянием между ядром и этими электронами. Благодаря этим электронам, которые легко отделяются от атома, Меркурий проводит электричество .
Помехи между валентными электронами и ядром увеличиваются из-за присутствия электронов на пяти орбитах между ними. Таким образом, уменьшая электростатическую силу между ними, эти электроны легко отделяются от внешней орбиты при подаче внешней энергии.
Какова электропроводность ртути? Материал считается электропроводящим, если электрический поток проходит через площадь его поперечного сечения. Обсудим электропроводность ртути. 93/см Ом. Сопротивление ртути будет противодействовать скорости потока через нее, тем самым уменьшая общую проводимость вещества.
93/см Ом. Сопротивление ртути будет противодействовать скорости потока через нее, тем самым уменьшая общую проводимость вещества.
Изменение электрического потока приводит к индуцированному магнитному полю. Магнитные потоки также ответственны за уменьшение проводимости ртути.
Является ли ртуть хорошим проводником электричества?Плотность заряда и электрическое поле металла должны быть равны нулю, чтобы он был хорошим проводником электричества. Давайте подробнее остановимся на том, является ли Hg хорошим проводником электричества или нет.
У Меркурия есть свободные электроны, которые поглощают и передают энергию, которая помогает им проводить электричество, несмотря на то, что они жидкие при нормальной температуре. Проводимость ртути даже лучше в металлической форме, так как скорость потока заряда не снижается из-за ее вязкости.
Структура и связь ртути Атомная структура и связь ртути зависят от числа ее валентных электронов и степени ее ионизации. Давайте обсудим структуру и связывание ртути дальше.
Давайте обсудим структуру и связывание ртути дальше.
- Ртуть имеет ромбоэдрическую форму в твердом состоянии с простой тригональной структурой и не является кристаллической при комнатной температуре.
- Ртуть используется для выплавки алюминиевых руд и реагирует с некоторыми кислотами с образованием хлоридов, сульфатов и нитратов, образуя ковалентный радиус 132 пм, и используется для выплавки алюминиевых руд.
Несколько свойств ртути делают ее уникальной среди всех других металлов. Давайте обсудим некоторые физические и химические свойства Hg ниже.
- Ртуть представляет собой серебристо-белый плотный переходный металл с полностью заполненной d-оболочкой, находящийся в жидком состоянии при комнатной температуре.
- Ртуть имеет высокую вязкость с температурой плавления 234,32 К и точкой кипения 629,88 К.

- Ртуть может растворять любые металлы, такие как золото и серебро, но не растворяет железо.
Все металлы обычно являются хорошими проводниками тепла. Выясним, является ли ртуть хорошим проводником тепла или нет.
Ртуть может передавать тепловую энергию от одного вещества к другому и имеет самое высокое значение коэффициента теплового расширения; следовательно, это хороший проводник тепла. То есть объем ртути увеличивается при получении небольшого количества тепла.
Проводит ли жидкая ртуть электричество и почему?Многие металлы в жидком состоянии обладают хорошими проводящими свойствами благодаря их удельному сопротивлению. Поговорим о проводимости электричества жидкой ртутью.
Жидкая ртуть проводит электричество, поскольку переход электронов может также происходить в жидком или расплавленном состоянии ртути.
Для возникновения проводимости должен существовать поток электронов, создаваемый жидкой ртутью. Но поскольку атомы упакованы неплотно, подвижность атомов может препятствовать потоку зарядов, и, таким образом, проводимость немного ниже по сравнению с твердым состоянием ртути.
Проводит ли твердая ртуть электричество и почему?Твердая ртуть податлива и пластична с нулевым электрическим полем через нее. Давайте посмотрим на проводимость электричества в твердом состоянии ртути.
Ртуть проводит электричество в своей твердой фазе из-за перехода электронов. Поскольку в твердом состоянии существует поток электронов, а движение атомов не прерывается потоком, проводимость стационарна.
Вывод В заключение этой статьи скажем, что ртуть является хорошим проводником тепла и электричества. Это переходный металл с двумя электронами на валентной оболочке, что делает его проводящим.
ртуть | Определение, использование, плотность и факты
Mercury
Посмотреть все СМИ
- Ключевые люди:
- Георг Брандт
- Похожие темы:
- переработка ртути эндокринный разрушитель нейротоксин отравление ртутью Болезнь Минамата
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
ртуть (Hg) , также называемая ртутью , химический элемент, жидкий металл группы 12 (IIb, или группа цинка) периодической таблицы.
.
| атомный номер | 80 | |||
|---|---|---|---|---|
| атомный вес | 200,592 | 1 | Плата | −38,83 ° C (−37,89 ° F) |
| ГРИБЛЯЯ | 356,62 ° C (673.91 ° F) | |||
| valence | 1, 2 | |||
| electron configuration | 2-8-18-32-18-2 or (Xe)4 f 14 5 d 10 6 s 2 |
Меркурий был известен в Египте и, вероятно, на Востоке еще в 1500 г. до н.э. Имя ртуть возникла в алхимии 6-го века, в которой символ планеты использовался для обозначения металла; химический символ Hg происходит от латинского Hydrargyrum , «жидкое серебро». Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях.
Ртуть — единственный элементарный металл, который находится в жидком состоянии при комнатной температуре. (Цезий плавится при температуре около 28,5 ° C [83 ° F], галлий примерно при 30 ° C [86 ° F] и рубидий примерно при 39 ° C [102 ° F].) Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе. , и замерзает в мягкое твердое вещество, такое как олово или свинец, при -38,83 ° C (-37,89°F). Он кипит при 356,62 ° C (673,91 ° F).
Он кипит при 356,62 ° C (673,91 ° F).
Сплавы с медью, оловом и цинком образуют амальгамы или жидкие сплавы. Амальгама с серебром используется в качестве пломбы в стоматологии. Ртуть не смачивает стекло и не прилипает к нему, и это свойство в сочетании с ее быстрым и равномерным объемным расширением во всем жидком диапазоне сделало ее полезной в термометрах. (Ртутные термометры были вытеснены более точными электронными цифровыми термометрами в начале 21 века.) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Хорошая электропроводность ртути делает ее исключительно полезной в герметичных электрических переключателях и реле. Электрический разряд через пары ртути, содержащиеся в трубке или колбе из плавленого кварца, создает голубоватое свечение, богатое ультрафиолетовым светом, явление, используемое в ультрафиолетовых, люминесцентных и ртутных лампах высокого давления. Некоторое количество ртути используется при приготовлении фармацевтических препаратов, а также сельскохозяйственных и промышленных фунгицидов.
В 20-м веке использование ртути в производстве хлора и гидроксида натрия путем электролиза рассола зависело от того факта, что ртуть, используемая в качестве отрицательного полюса или катода, растворяет выделяющийся натрий с образованием жидкой амальгамы. Однако в начале 21 века заводы с ртутными элементами для производства хлора и гидроксида натрия в основном были выведены из эксплуатации.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Ртуть встречается в земной коре в среднем в количестве около 0,08 грамма (0,003 унции) на тонну породы. Основная руда — красный сульфид, киноварь. Самородная ртуть встречается в виде отдельных капель, а иногда и в более крупных жидких массах, обычно с киноварью, вблизи вулканов или горячих источников. Найдены также крайне редкие природные сплавы ртути: мошелландсбергит (с серебром), потарит (с палладием), амальгама золота. Более 90 процентов мировых поставок ртути поступает из Китая; часто это побочный продукт добычи золота.
Киноварь добывают шахтным или открытым способом и очищают флотацией. Большинство методов извлечения ртути основаны на летучести металла и на том факте, что киноварь легко разлагается на воздухе или известью с образованием свободного металла. Ртуть извлекают из киновари путем ее обжига на воздухе с последующей конденсацией паров ртути. Из-за токсичности ртути и угрозы жесткого контроля за загрязнением внимание уделяется более безопасным методам извлечения ртути. Обычно они основаны на том факте, что киноварь легко растворяется в растворах гипохлорита или сульфида натрия, из которых ртуть может быть извлечена осаждением цинком или алюминием или электролизом. (Для обработки промышленного производства ртути см. обработка ртути; по минералогическим свойствам см. самородный элемент [таблица].)
Обычно они основаны на том факте, что киноварь легко растворяется в растворах гипохлорита или сульфида натрия, из которых ртуть может быть извлечена осаждением цинком или алюминием или электролизом. (Для обработки промышленного производства ртути см. обработка ртути; по минералогическим свойствам см. самородный элемент [таблица].)
Ртуть токсична. Отравление может произойти в результате вдыхания паров, проглатывания растворимых соединений или всасывания ртути через кожу.
Природная ртуть представляет собой смесь семи стабильных изотопов: 196 Hg (0,15 %), 198 Hg (9,97 %), 199 Hg (16,87 %), 200 Hg (23,1015 %), рт.ст. (13,18%), 202 Hg (29,86 процента) и 204 Hg (6,87 процента). Изотопно чистая ртуть, состоящая только из ртути-198, полученная бомбардировкой нейтронами природного золота, золота-197, использовалась в качестве эталона длины волны и для других точных работ.
Ртуть — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Таллий >
| Группа | 12 | Точка плавления | -38,829 ° С, -37,892 ° F, 234,321 К |
| Период | 6 | Температура кипения | 356,619 ° С, 673,914 ° F, 629,769 К |
| Блок | г | Плотность (г см -3 ) | 13,5336 |
| Атомный номер | 80 | Относительная атомная масса | 200,592 |
| Состояние при 20°C | Жидкость | Ключевые изотопы | 202 рт. ст. ст. |
| Электронная конфигурация | [Xe] 4f 1 4 5d 1 0 6s 2 | Номер КАС | 7439-97-6 |
| ChemSpider ID | 22373 | ChemSpider — бесплатная база данных химической структуры. | |
Изображение представляет собой традиционный алхимический символ ртути. Это также астрологический символ планеты Меркурий. Дракон или змей на заднем плане происходят из ранних алхимических рисунков и часто ассоциируются с элементом.
Жидкий серебристый металл.
Ртуть на протяжении тысячелетий очаровывала людей как тяжелый жидкий металл. Однако из-за ее токсичности многие виды использования ртути прекращаются или пересматриваются.
В настоящее время в основном используется в химической промышленности в качестве катализаторов. Он также используется в некоторых электрических переключателях и выпрямителях.
Ранее его основным применением было производство гидроксида натрия и хлора путем электролиза рассола. Все эти растения будут выведены из эксплуатации к 2020 году. Он также широко использовался в батареях, люминесцентных лампах, производстве войлока, термометрах и барометрах. Опять же, эти виды использования были прекращены.
Опять же, эти виды использования были прекращены.
Ртуть легко образует сплавы, называемые амальгамами, с другими металлами, такими как золото, серебро и олово. Легкость, с которой он смешивается с золотом, сделала его полезным для извлечения золота из руд. Амальгамы ртути также использовались в зубных пломбах.
Сульфид ртути (киноварь) — это высококачественный ярко-красный пигмент для краски, но он очень токсичен, поэтому в настоящее время используется с большой осторожностью.
Ртуть не играет известной биологической роли, но присутствует во всех живых существах и широко распространена в окружающей среде. Каждый глоток пищи, которую мы едим, содержит немного ртути.
Наше ежедневное потребление составляет менее 0,01 миллиграмма (около 0,3 грамма за всю жизнь), и с этим мы легко справимся. Однако в гораздо более высоких дозах она токсична, а одна из форм ртути — метилртуть — особенно опасна. Он может накапливаться в мясе рыб и поедать людей, вызывая у них болезни.
Ртуть редко встречается в природе в чистом виде, но ее можно найти в виде капель в киноварных (сульфидных ртутных) рудах. Китай и Кыргызстан являются основными производителями ртути. Металл получают нагреванием киновари в токе воздуха и конденсацией паров.
Элементы и история периодической таблицы
Киноварь (также известная как киноварь, сульфид ртути, HgS) использовалась в качестве ярко-красного пигмента палеолитическими художниками 30 000 лет назад для украшения пещер в Испании и Франции. Киноварь выделяла свою ртуть просто при нагревании в тигле, и этот металл очаровывал людей, потому что это была жидкость, которая растворяла золото. Древние использовали в больших масштабах для добычи россыпного золота из наносов рек. Ртуть растворяла золото, которое можно было восстановить, отогнав ртуть.
Месторождение Альмаден в Испании снабжало Европу ртутью. В Америке именно испанские завоеватели использовали большие залежи киновари в Уанкавелике для добычи золота. В 1848 году горняки во время калифорнийской золотой лихорадки использовали ртуть из шахт Нью-Алмаден в Калифорнии.
В 1848 году горняки во время калифорнийской золотой лихорадки использовали ртуть из шахт Нью-Алмаден в Калифорнии.
Несмотря на высокую токсичность, ртуть нашла множество применений, например, в термометрах, но сейчас они строго засекречены.
| Атомный радиус, несвязанный (Å) | 2,23 | Ковалентный радиус (Å) | 1,32 |
| Сродство к электрону (кДж моль -1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | 1,9 |
| Энергии ионизации (кДж моль -1 ) | г. 1 ст 1007.066 2 и 1809.756 3 рд 3299,8 | ||
| Общие степени окисления | 2 , 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
196 рт. ст. ст. | 195.966 | 0,15 | > 2,5 х 10 18 г | α | |
| 198 рт.ст. | 197,967 | 9,97 | — | — | |
199 рт. ст. ст. | 198,968 | 16,87 | — | — | |
| 200 рт.ст. | 199.968 | 23.1 | — | — | |
201 рт. ст. ст. | 200.970 | 13.18 | — | — | |
| 202 рт.ст. | 201.971 | 29,86 | — | — | |
204 рт. ст. ст. | 203,973 | 6,87 | — | — | |
|
|
| Удельная теплоемкость (Дж кг −1 К −1 ) | 140 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | 25 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст Меркьюри |
Стенограмма: (Promo) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журнал Королевского химического общества. (Конец промо) Крис Смит Привет! На этой неделе мы исследуем связь между безумными шляпниками, тушью для ресниц, императорами Китая и рыбацкими поплавками; странная комбинация, вы могли бы сказать, но, вероятно, не настолько странная, как эта! Фред Кэмпбелл Может ли человек пройти через бассейн, наполненный ртутью? Не спрашивайте меня, как разговор дошел до этого места, но, находясь в окружении друзей, которые, честно говоря, назвали бы себя неграмотными в науке, я знал, что это зависит от меня, условного ученого, сидящего за столом. дайте окончательный ответ. «Нет.» Я уверенно сказал, добавив несколько самодовольно: «Он далеко не достаточно плотный». На следующее утро меня грубо разбудил звонок мобильного; Я был неправ! Элементарная ртуть, жидкая при комнатной температуре, в 13 раз плотнее воды. Достаточно получается, чтобы поддержать мужчину средней комплекции и да, если набрать человека, сидящего на Меркурии в Google, вы быстро найдете фотографию 1972 года, опубликованную в National Geographic, на которой мужчина в костюме и в ботинках сидит без посторонней помощи, хотя и немного нервно, на вершине резервуара с пульсирующей ртутью. Греческое название Hydrargyrum , буквально означающее «жидкое серебро», неудивительно, что за последние три тысячелетия цивилизации были поражены, веря, что ртуть обладает чудесными физическими и духовными свойствами. . Римляне были известны тем, что использовали его в косметике, часто при этом уродуя свои лица. Египтяне были похоронены с ним, чтобы продемонстрировать доблесть их цивилизаций в добыче полезных ископаемых, а древние китайцы пили смертоносные коктейли ртути в поисках вечной жизни и благополучия. Говорят, что первый император Китая Цинь Ши Хуан так сильно верил в магические свойства Меркурия, что умер, стремясь к бессмертию, откашлявшись. Переходим к 18-му -му -му веку, и впервые психологические заболевания были связаны с воздействием ртути. В безумии многих миллионеров обвиняли широкое использование нитрата ртути в шляпной промышленности и фразу м реклама в качестве шляпника год. Эта ссылка почти наверняка вдохновила Льюиса Кэрролла на создание Безумного Шляпника, хотя многие споры ведутся по поводу того, действительно ли у него проявляются симптомы отравления ртутью. С этого момента опасности ртути были хорошо задокументированы; но, несмотря на его токсичность, он продолжал находить множество применений в повседневных приложениях на протяжении всего прошлого века. Чтобы не перечислять огромный список странных и замечательных применений ртути, я хотел бы лишь вкратце упомянуть о моем личном фаворите, рыболовных поплавках, используемых для поддержания регулярного колебания на поверхности воды, ртутный поплавок оказывается настолько привлекательным для рыбы, что даже сейчас после того, как его использование было запрещено во всем мире, ведутся активные исследования, чтобы найти замену для выполнения той же работы. С одной стороны, мне грустно думать, что ртуть в конце концов станет стихийным артефактом, безнадежно застрявшим между золотом и таллием в таблице Менделеева, но с другой, она постоянно напоминает мне об опасностях, которые скрываются за фасадом ее прекрасного серебряный блеск. Что же касается человека, сидящего в чане с ртутью, то, к сожалению, я все еще жду ответа от National Geographic, хотя ради него мы можем только надеяться, что он живет долгой и здоровой жизнью и не присоединился к длинному списку многочисленные жертвы ртути. Крис Смит Фред Кэмпбелл из Chemistry World об использовании и злоупотреблениях элементом номер 80, быстрым серебром, также известным как ртуть. Adina Payton Первое, что приходит на ум большинству людей при упоминании этого элемента, это клизма с барием или глоток с барием, болезненные воспоминания часто всплывают на поверхность после рентгенологической клиники, где милая медсестра спросила вас: «какой аромат вам нравится». , клубника или банан’ . Крис Смит Трудно проглотить, можно сказать, но, к счастью, очень удобоваримое описание бария. Это придумывается с Адиной Пэйтон на Химии на следующей неделе в своей стихии. Я Крис Смит, спасибо за внимание и до свидания! (Promo) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (конец акции) |
Нажмите здесь, чтобы просмотреть видеоролики о Mercury
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
Data
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
Таблица 907 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
Использование и свойства
John Emsley, Строительные блоки природы: руководство по элементам от А до Я , Oxford University Press, New York, 2nd, New York, 2nd Издание 2011 г.


 2 Одни из самых популярных пломб в свое время -амальгама. Пломба амальгама включает в свой состав смесь твердых металлов и ртуть. Ртуть использовалась из-за свойства растворять металлы. Таким образом пломба заполняла кариозную полость и затвердевала в ней.
2 Одни из самых популярных пломб в свое время -амальгама. Пломба амальгама включает в свой состав смесь твердых металлов и ртуть. Ртуть использовалась из-за свойства растворять металлы. Таким образом пломба заполняла кариозную полость и затвердевала в ней. Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.




 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;

 Это в основном связано с ненормальным поведением электронов, вращающихся вокруг атома, и делает его одним из пяти элементов, которые в нормальном состоянии находятся в жидком состоянии.
Это в основном связано с ненормальным поведением электронов, вращающихся вокруг атома, и делает его одним из пяти элементов, которые в нормальном состоянии находятся в жидком состоянии. Все атомы могут стать твердыми , жидкими , газом или плазмой, и это просто вопрос свойств и температуры атома, находится ли он в любом из этих состояний.
Все атомы могут стать твердыми , жидкими , газом или плазмой, и это просто вопрос свойств и температуры атома, находится ли он в любом из этих состояний. Матер. 12 , 515 (1999).
Матер. 12 , 515 (1999). , Росцишевский, К., Швердтфегер, П. и Столл, Х. Решетчатая структура ртути: влияние электронной корреляции. Физ. Ред. B 74 , 094102 (2006 г.).
, Росцишевский, К., Швердтфегер, П. и Столл, Х. Решетчатая структура ртути: влияние электронной корреляции. Физ. Ред. B 74 , 094102 (2006 г.).